Tlenki
W siódmej klasie szkoły podstawowej uczniowie poznają tlen i jego właściwości. Wysoka aktywność chemiczna tlenu sprawia, że tworzy on związki z niemal wszystkimi pierwiastkami układu okresowego. Produkty łączenia się tych pierwiastków z tlenem nazywamy tlenkami.
Z zestawami „Atomków” do chemii nieorganicznej (podstawowy lub rozszerzony) można ćwiczyć budowę poszczególnych tlenków i lepiej zrozumieć zasady łączenia się pierwiastków w związki chemiczne oraz tworzenia wzorów sumarycznych. Rozdajemy zestawy i prosimy uczniów o samodzielne zbudowanie cząsteczek kilku najważniejszych tlenków metali i niemetali. Po kilku próbach uczniowie sami odkryją zasadę tworzenia takich struktur oraz opisywania ich wzorami sumarycznymi.
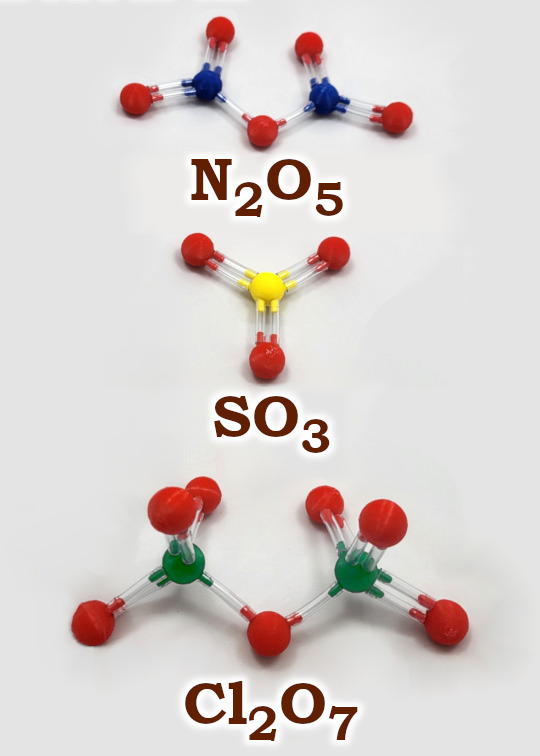
Na grafice poniżej widać typowe tlenki niemetali o wyższych wartościowościach – od 5 do 7. Widać, że jeżeli wartościowość pierwiastka jest parzysta, to budowa tlenku jest trywialna. Jeden atom pierwiastka jest w centrum i otaczają go dwuwartościowe atomu tlenu. Natomiast w przypadku wartościowości nieparzystej do budowy tlenku konieczne są dwa atomy danego pierwiastka połączone za pomocą atomu tlenu. Działa to dla wszystkich wartościwości od 1 do 7.
Gdy uczniowie opanują już podstawy możemy im pokazać tlenki bardziej złożone. W szkole podstawowej zazwyczaj wspomina się o dwóch „nietypowych” tlenkach: tlenku żelaza(II) diżelaza(III) (Fe3O4) oraz o tlenku fosforu(V) (P4O10). Proponujemy pokazać uczniom jeszcze trzeci – o wzorze Cl2O3. Wbrew oczekiwaniom, nie ma w jego cząsteczce trójwartościowych atomów chloru. W zamian jest jeden atom chloru pięciowartościowego i jeden atom chloru jednowartościowego. Dlatego prawidłowa jego nazwa to tlenek chloru(I) chloru(V).

Każdy z tych trzech tlenków jest wyjątkowy na swój sposób i wspaniałym ćwiczeniem dla uczniów będzie samodzielne zaproponowanie struktur tych cząsteczek znając jedynie ich wzory sumaryczne (aby ułożyć tlenek fosforu(V) oraz tlenek chloru(I) chloru(V) niezbędny będzie zestaw rozszerzony).
Na tym jednak nie koniec. Obserwując złożone przez siebie modele, uczniowie mogą zadać zadać pytanie: dlaczego tlenek siarki(IV) ma budowę kątową, a tlenek węgla(IV) ma budowę liniową? Odpowiedź jest oczywiście niemożliwa na poziomie wiedzy siódmoklasisty, ale chęć jej poznania może stanowić wspaniałą zachętę do dalszego zgłębiania sekretów chemii.

🤔 Ciekawostki 🤔
- Tlen tworzy związki z fluorem, jednak w tym jedynym wypadku takiego związku nie nazwiemy tlenkiem fluoru, a fluorkiem tlenu. Jego wzór chemiczny też zapisujemy inaczej niż inne wzory związków tlenu: OF2.
- Tlen jest pierwiastkiem na tyle aktywnym, że znane są nawet jego związki z niektórymi gazami szlachetnymi. Jako przykład można wskazać dwa tlenki ksenonu: XeO3 oraz XeO4.
- Mimo, że istnieje kwas chlorowy(V), to nie istnieje bezwodnik tego kwasu – tlenek chloru(V).
- Nie istnieje ani jeden tlenek o budowie kowalencyjnej z trójwartościowym pierwiastkiem, który moglibyśmy zbudować jako O=X–O–X=O – czyli zgodnie z omówionym wyżej szkolnym schematem tworzenia wzorów strukturalnych tlenków. Wszystkie tlenki trójwartościowych niemetali albo mają niesymetryczną cząsteczkę (np. pokazany wyżej tlenek chloru(III)), albo tworzą większe struktury przestrzenne (np. tlenek fosforu(III)), albo w ogóle nie tworzą klasycznych cząsteczek, tylko duże struktury krystaliczne (np. tlenek boru).
⚠️ Zastrzeżenie ⚠️
Struktury widoczne na zdjęciu są przedstawione w sposób umożliwiający percepcję uczniowi siódmej klasy szkoły podstawowej posługującemu się klasycznym pojęciem wartościowości. W szczególności: wiązania koordynacyjne zastępowane są wiązaniem podwójnym, a także w uproszony sposób potraktowano związki jonowe. Rurka łącząca atomy związkach jonowych nie symbolizuje pary elektronów, tylko oddziaływanie elektrostatyczne. Pamiętać też należy, że związki jonowe występują w postaci kryształów i nie tworzą klasycznych cząsteczek.
🧐 Zobacz też 🧐
Jeżeli chcesz pogłębić temat tlenków i ułożyć więcej nietypowych struktur, to gorąco polecam także:
Łukasz Aranowski
27 marca 2023
