Tlenki azotu – kompendium maturzysty i olimpijczyka
Dzisiaj opowiemy wszystko, co zainteresowany chemią maturzysta powinien wiedzieć o TLENKACH AZOTU. To będzie dłuuugi wpis. 😊
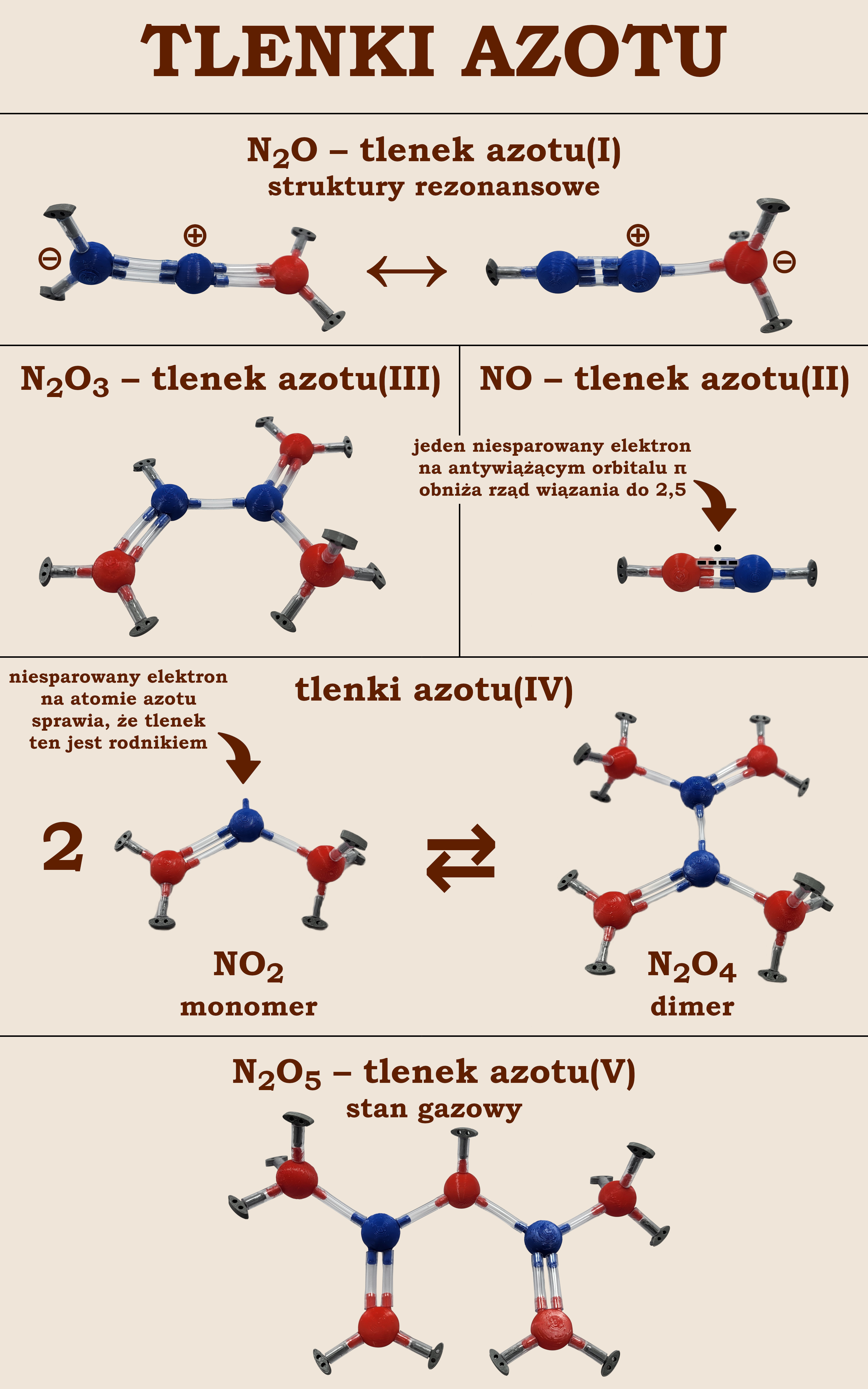
Wszystkie widoczne na ilustracji cząsteczki można ułożyć z „Atomków” posiadając zestaw Lewisa do chemii nieorganicznej. Układając te struktury samodzielnie uczniowie dużo lepiej je zrozumieją i zapamiętają.
🧪 Tlenek azotu(I) – N2O 🧪
Bezbarwny gaz o słodkim zapachu. Wbrew swojemu wzorowi nie jest bezwodnikiem kwasu diazotowego(I), H2N2O2. Choć nietrwały kwas diazotowy rozkłada się z wydzieleniem tego właśnie tlenku:
H2N2O2 → N2O + H2O
to jest to tlenek obojętny – nie reaguje z wodą, kwasami i zasadami.
W laboratorium otrzymuje się go ogrzewając ostrożnie azotan(V) amonu:
NH4NO3 → N2O + 2H2O
Nazywany jest „gazem rozweselającym”, bo wdychany działa na organizm rozluźniająco i znieczulająco. Choć kiedyś powszechnie stosowany, zwłaszcza w stomatologii, to we współczesnej medycynie używany jest już tylko jako nośnik innych środków znieczulających. Jego doskonałą rozpuszczalność w tłuszczach wykorzystano natomiast w przemyśle spożywczym do tworzenia piany z bitej śmietany w spraju. Inna własność tego tlenku wykorzystywana jest w tuningu samochodowym. Rozkłada się on z wydzieleniem tlenu, więc po wtryśnięciu go do cylindrów gwałtownie zwiększa ilość spalanej mieszanki dając efekt krótkotrwałego zwiększenia mocy silnika.
Ma też swoją „ciemną stronę” – jest to gaz o wysokim potencjale tworzenia efektu cieplarnianego (GWP100(*) = 273). Jest on wprawdzie składnikiem naturalnego cyklu azotowego, jednak obecnie za 40% jego emisji do atmosfery odpowiada człowiek. Jego źródłem są przede wszystkim niepobrane przez rośliny nawozy azotowe przekształcone przez bakterie oraz grzyby.
Jego cząsteczka jest izoelektronowa z tlenkiem węgla(IV) oraz z omawianym tu wcześniej jonem azydkowym. Podobnie jak ten ostatni tworzy dwie formy mezomeryczne widoczne na ilustracji.
🧪 Tlenek azotu(II) – NO 🧪
Bezbarwny i bezwonny gaz. Jest tlenkiem obojętnym – nie reaguje z wodą, kwasami i zasadami. W obecności tlenu (np. z powietrza) samorzutnie utlenia się do NO2:
2NO + O2 → 2NO2
Jak wiadomo, azot bardzo niechętnie bezpośrednio reaguje z tlenem. Dzięki temu możliwe jest istnienie naszej atmosfery składającej się z mieszaniny tych dwóch gazów. Jeżeli jednak go do tego zmusimy (w temperaturze powyżej 3000 K osiąganej np. w łuku elektrycznym) powstaje właśnie ten tlenek. Jednak przemysłowo otrzymuje się go prościej; spalając amoniak w temperaturze 1100 K na katalizatorze platynowym z niewielką domieszką rodu (metoda Ostwalda):
4NH3 + 5O2 → 4NO + 6H2O
W laboratorium jest produktem działania rozcieńczonego (poniżej 30%) kwasu azotowego(V) na metale. Przykładowa reakcja wygląda następująco:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Struktura jego cząsteczki przypomina dobrze nam znane drobiny, takie jak: N2, CO czy CN-. Posiada jednak dodatkowy niesparowany elektron, co czyni ją rodnikiem. Zgodnie z metodą LCAO MO elektron ten zajmuje antywiążący orbital π obniżając rząd wiązania z 3 do 2,5. Powoduje to, że budowa tej cząsteczki z „Atomków” jest problematyczna i wymaga komentarza nauczyciela. Na ilustracji oznaczono dodatkowy elektron oraz jedno wiązanie jako połówkowe.
🧪 Tlenek azotu(III) – N2O3 🧪
Powstaje z oziębionej do -15℃ równocząsteczkowej mieszaniny NO i NO2:
NO + NO2 ⇄ N2O3
Występuje wtedy jako niebieska ciecz. Jednak w miarę podnoszenia temperatury równowaga tej reakcji przesuwa się w lewo. Powyżej -2℃ z układu zaczyna szybko ulatniać się NO, co gwałtownie przyspiesza rozkład, a ciecz uzyskuje żółte zabarwienie dzięki bogatej zawartości NO2. Po jej całkowitym odparowaniu uzyskuje się równowagową mieszaninę NO, NO2 i N2O3, w której zawartość N2O3 w temperaturze pokojowej nie przekracza 10%.
Tlenek azotu(III) jest bezwodnikiem nietrwałego kwasu azotowego(III). Wprowadzenie do wody mieszaniny NO i NO2 powoduje powstanie niewielkich ilości N2O3. Reaguje on z wodą:
N2O3 + H2O → 2HNO2
zakłócając równowagę swojej syntezy, co powoduje powstawanie kolejnych porcji N2O3, które dalej reagują z wodą i tak dalej. Więcej informacji znajdziesz w artykule o kwasie azotowym(III) i jego solach.
Jego cząsteczka jest niesymetryczna i zawiera słabe pojedyncze wiązanie N—N o długości 186 pm. Jeden z atomów azotu przyłącza dwa atomy tlenu. Stwierdzona niemal identyczna długość tych wiązań wskazuje, że w rzeczywistości tworzą one dwie graniczne struktury rezonansowe, które składają się na zdelokalizowane wiązanie π.
Z przedstawionej budowy tego tlenku wnioskujemy, że nazwa wynikająca z wzoru sumarycznego – tlenek azotu(III) – jest tylko zwyczajowa. Nie ma w nim bowiem atomów azotu na trzecim stopniu utlenienia. Formalnie tlenek ten powinniśmy nazwać: tlenek azotu(II) azotu(IV).
🧪 Tlenek azotu(IV) – NO2 oraz N2O4 🧪
NO2 to brunatny trujący gaz o kwaśnym, nieprzyjemnym zapachu. Powstaje w procesie utlenienia tlenku azotu(II). W laboratorium otrzymujemy go w reakcji metali nieulegających pasywacji ze stężonym kwasem azotowym(V), np.:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
lub prowadząc rozkład termiczny azotanów(V), np.:
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑
Jest tlenkiem kwasowym, który dysproporcjonuje z wodą do kwasów azotowych:
2NO2 + H2O → HNO2 + HNO3
Poniżej temperatury 150℃ pozostaje w równowadze ze swoim dimerem N2O4:
2NO2 ⇄ N2O4
W miarę obniżania temperatury stopniowo rośnie udział bezbarwnego N2O4, co powoduje stopniowe odbarwianie się układu. Poniżej temperatury 21℃ ze stanu gazowego mieszanina przechodzi w ciemnoczerwoną ciecz, a poniżej -9℃ – w jasnopomarańczowe ciało stałe. W bardzo niskich temperaturach (rzędu 100 K) odbarwia się całkowicie, co oznacza, że układ składa się już niemal wyłącznie z dimeru N2O4.
Ciekły N2O4 ulega słabej autodysocjacji z wytworzeniem jonów nitrozylowego i azotanowego(V):
N2O4 ⇄ NO+ + NO3-
Cząsteczka NO2 jest rodnikiem. Ma budowę trójkątną i dwie formy rezonanowe składające się na zdelokalizowany orbital π. Budując ją z „Atomków” pozostawiamy jedną wypustkę na atomie azotu bez wiązania. Symbolizuje ona niesparowany elektron.
Budowa cząsteczki N2O4 polega na połączeniu pojedynczym wiązaniem σ dwóch atomów azotu w cząsteczkach NO2. Warto zwrócić uwagę, że, ponieważ taka cząsteczka zawiera dwa zdelokalizowane orbitale π, to możemy zbudować aż cztery struktury graniczne.
🧪 Tlenek azotu(V) – N2O5 🧪
Białe, krystaliczne ciało stałe, sublimujące w temperaturze 33℃.
Jest bezwodnikiem kwasu azotowego(V) gwałtownie reagującym z wodą:
N2O5 + H2O → 2HNO3
Reakcja odwrotna – odwodnienia kwasu azotowego(V) tlenkiem fosforu(V) – jest wykorzystywana do laboratoryjnego otrzymywania tego tlenku:
4HNO3 + P4O10 → 2N2O5 + 4HPO3
W temperaturze pokojowej stopniowo rozkłada się na tlenek azotu(IV) i tlen:
2N2O5 → 4NO2↑ + O2↑
Z powodu swojej nietrwałości nie znalazł żadnych praktycznych zastosowań.
Jest to jedyny tlenek azotu posiadający w stanie gazowym strukturę przewidywalną na poziomie szkoły podstawowej z użyciem klasycznego pojęcia wartościowości – z symetryczną, płaską cząsteczką. Na poziomie szkoły średniej pokazujemy uczniom, że posiada ona aż cztery struktury graniczne, które składają się na dwa zdelokalizowane orbitale π na przeciwległych końcach tej cząsteczki.
W stanie stałym, podobnie jak znany nam już tlenek chloru(VI), ma budowę jonową:
N2O5 ⇄ [NO2]+[NO3]-
W tej postaci jest to więc sól – azotan nitroilu. Nie pokazujemy na ilustracji jego struktury jonowej, bo o jonowej budowie niektórych tlenków niemetali będzie oddzielny artykuł.
Warto polubić profil „Atomków” na Fejsbuku i dodać go do ulubionych, aby nie przegapiać kolejnych ciekawych wpisów. 👨🔬
Ale w pierwszym rzędzie warto kupić „Atomki”! 😊
Łukasz Aranowski
7 listopada 2023
Przypisy
(*) GWP100 (ang. global warming potential) to wskaźnik określający stosunek absorpcji promieniowania podczerwonego przez określoną masę gazu do absorpcji promieniowania podczerwonego przez identyczną masę masę dwutlenku węgla (zatem dla dwutlenku węgla GWP zawsze jest równy 1). W praktyce, mierzy on stosunek ciepła zatrzymywanego przez opisywany gaz w stosunku do ciepła zatrzymywanego przez dwutlenek węgla. Liczba oznacza okres w latach (w tym przypadku: 100 lat). Wartość wskaźnika zależy więc nie tylko od stopnia absorpcji promieniowania termicznego przez dany gaz, ale również od czasu życia tego gazu w atmosferze.
