Tlenki chloru – nie takie trudne
Zarówno w szkole podstawowej, jak i później – w szkole średniej – unika się omawiania z uczniami tlenków chloru. 😊
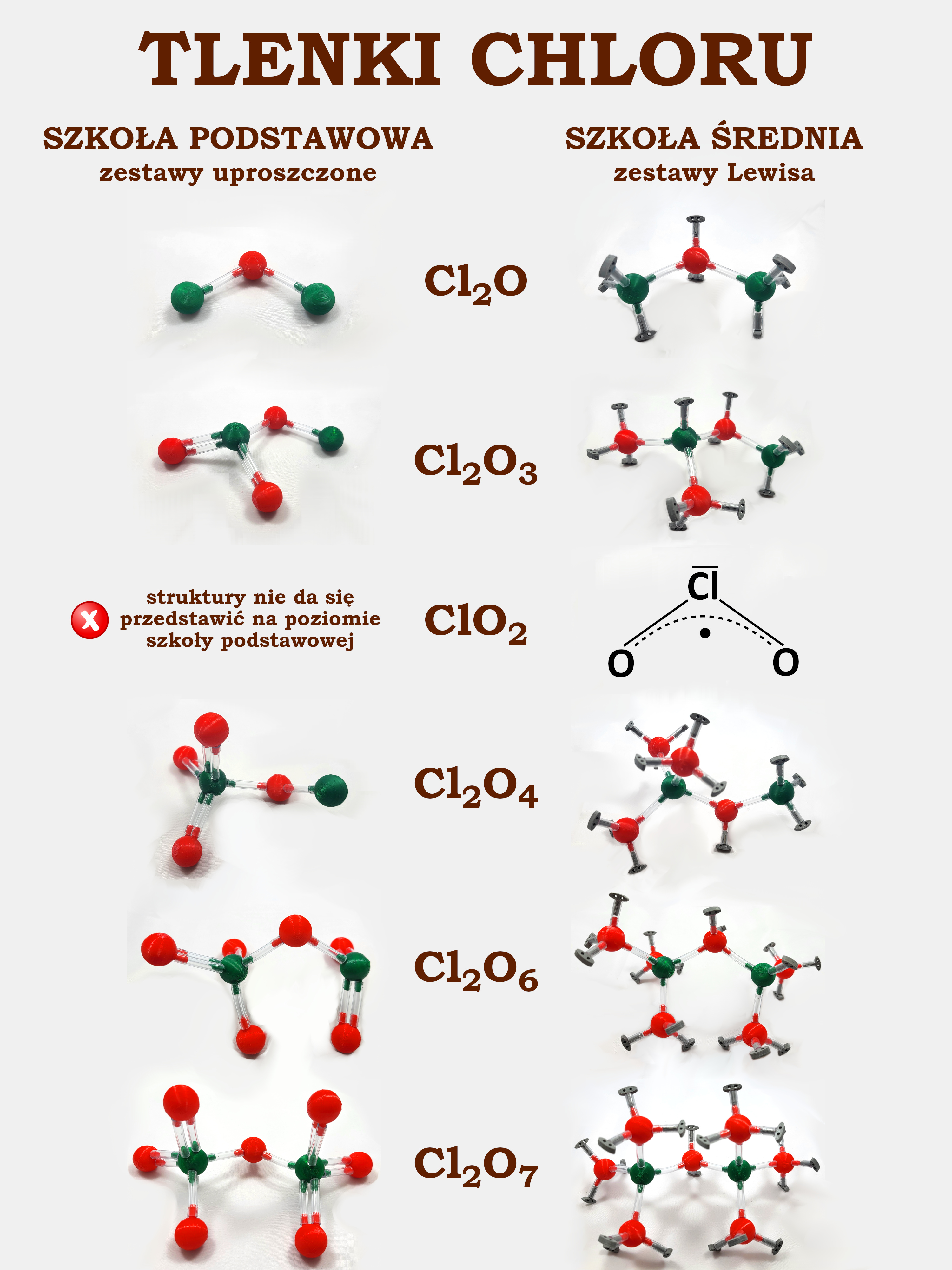
Jest tak dlatego, że poza tlenkami chloru(I) i chloru(VII), których budowę może przewidzieć nawet siódmoklasista, pozostałe tlenki chloru mają strukturę nieintuicyjną. Jednak posiadając „Atomki” możemy samodzielnie zbudować większość tych cząsteczek i objaśnić je na każdym poziomie zaawansowania.
Przy okazji przyjrzymy się, czym się różnią zestawy uproszczone „Atomków” od zestawów Lewisa. 🧐
Tlenki dichloru
Chlor tworzy aż sześć tlenków – na +1, +3, +4 (dwa tlenki), +6 i +7 stopniu utlenienia.
Jeden z tych tlenków – dwutlenek chloru, ClO2 – jest strukturą bardzo skomplikowaną i opiszemy go dalej.
W pozostałych pięciu tlenkach zarówno atomy chloru jak i atomy tlenu przyjmują hybrydyzację sp3. Po utworzeniu pojedynczego wiązania kowalencyjnego σ z atomem tlenu łączącym dwa atomy chloru, każdy atom chloru przyłącza kolejne atomy tlenu wiązaniami koordynacyjnymi. Ponieważ ma on trzy wolne pary elektronowe, to może przyłączyć w ten sposób trzy dodatkowe atomy tlenu.
Zaczynamy więc budowę od tlenku chloru(I), a następnie „syntezujemy” kolejne tlenki wymieniając odpowiednią liczbę par elektronowych przy atomach chloru na pojedyncze wiązania koordynacyjne do atomów tlenu. Robiąc tę operację wysycamy tlenem najpierw jeden atom chloru, a dopiero gdy zabraknie na nim wolnych par elektronowych przechodzimy do drugiego.
Powyższa prawidłowość, umożliwia nam samodzielne zbudowanie i zapamiętanie wszystkich tlenków dichloru. Widać też z tego schematu, że poza tlenkami chloru(I) oraz chloru(VII) wszystkie tlenki zawierające dwa atomy chloru mają cząsteczki asymetryczne.
W zestawach uproszczonych nie pokazujemy wolnych par elektronowych na atomach, a wiązania koordynacyjne – zgodnie z powszechnym zwyczajem – zastępujemy wiązaniami podwójnymi. Dzięki temu zabiegowi możemy posługiwać się klasycznym pojęciem wartościowości w miejsce stopnia utlenienia.
Dwutlenek chloru
Pozostał nam jeszcze jeden tlenek chloru do omówienia.
Dwutlenek chloru, ClO2 posiada jeden niesparowany elektron, a zatem jest rodnikiem. Zakładając hybrydyzację sp3 na atomie chloru dałoby się go przedstawić za pomocą zestawu Lewisa. Niestety, nie byłaby to struktura prawidłowa.
Rzeczywisty kąt między wiązaniami w tym związku wynosi 117°, a długość wiązań (148 pm) wskazuje na ich formę pośrednią pomiędzy wiązaniem pojedynczym a podwójnym. Oznacza to, że atom chloru posiada hybrydyzację sp2, a sama cząsteczka ma dwie formy rezonansowe i zdelokalizowany orbital π. Budowa tej cząsteczki wymyka się więc uczonemu w szkołach średnich schematowi uzyskiwania przez atomy oktetu elektronowego, gdyż atom chloru miałby tu dziewięć elektronów (mówimy, że jest to związek hiperwalencyjny).
Z powodu tego jednego dodatkowego elektronu, dwutlenku chloru, jako jedynego tlenku chloru, nie zbudujemy z „Atomków”. 😟 Jego strukturę przedstawiliśmy wzorem kreskowym.
Kilka ciekawostek
- Większość tlenków chloru jest niestabilna, a ich rozkład może przebiegać wybuchowo.
- Nie istnieje tlenek chloru(V), a zatem kwas chlorowy(V) nie ma swojego bezwodnika. Kwas ten powstaje w procesie dysproporcjonowania dwutlenku chloru:
2ClO2 + H2O → HClO2 + HClO3
Przypomina to znaną ze szkoły reakcję dysproporcjonowania dwutlenku azotu (NO2), który, nawiasem pisząc, też jest rodnikiem. - Widoczna na grafice struktura tlenku chloru(VI) jest prawdziwa tylko w stanie gazowym. W stanie ciekłym i stałym substancja ta jonizuje i jej struktura wygląda następująco: [ClO2]+[ClO4]-.
Jakie zestawy wybrać?
- Aby zbudować każdy z tlenków chloru na poziomie szkoły podstawowej wystarczy uproszczony zestaw rozszerzony (200 el.) do chemii nieorganicznej.
- Aby zbudować każdy z tlenków chloru na poziomie szkoły średniej należy zaopatrzyć się w zestaw Lewisa (150 el.) do chemii nieorganicznej. W przypadku dwóch tlenków chloru na dwóch najwyższych stopniach utlenienia trzeba będzie poratować się dodatkowymi atomami tlenu – np. z zestawu Lewisa do chemii organicznej.
Łukasz Aranowski
14 października 2023
