Polijodki – czyli czemu jod rozpuszcza się w jodku potasu?
Uczniowie szkoły średniej rozszerzający chemię dowiadują się, że rozpuszczalność jodu w wodzie jest wielokrotnie mniejsza niż chloru lub bromu. To dlatego tzw. „woda jodowa” ma tak małe stężenie, że w zasadzie nie ma żadnych praktycznych zastosowań. Jest jednak pewna sztuczka, która sprawia, że możemy rozpuścić w wodzie całkiem dużo czystego jodu. Wystarczy dodać do roztworu pewną ilość jonów I⁻, na przykład z jodku potasu.
Ustala się wtedy równowaga:
I2 + I- ⇄ I3-
Stała równowagi tej reakcji w temperaturze pokojowej jest bardzo wysoka (K = 723 ± 10), więc dzięki temu wybiegowi możemy w naszym roztworze osiągnąć o całe rzędy wielkości większe stężenia jodu niż w czystej wodzie. Tak powstaje popularny ostatnio płyn Lugola.
Jednak to dopiero początek fascynującej przygody ze związkami, które chemicy nazwali polijodkami.
Okazuje się, że jeżeli zamiast wody użyjemy jakiegoś polarnego rozpuszczalnika organicznego (np. etanolu lub acetonu), to powstają również dłuższe łańcuchy polijodkowe. Mało tego – potrafią one rozgałęziać się oraz tworzyć struktury przestrzenne liczące nawet kilkadziesiąt atomów jodu.
Na grafice widzicie kolejne polijodki I3⁻, I42-, I5-, I7-. Wszystkie one składają się podstawowych cegiełek, którymi są anion jodkowy I- oraz cząsteczka jodu I2. Skrajne atomy oraz węzły mają tetraedryczną hybrydyzację sp3, natomiast środkowe elementy łańcucha mają bipiramidalną hybrydyzację sp3d, co pozwala swobodnym jonom polijodkowym zachowywać niemal idealnie liniowe kształty.
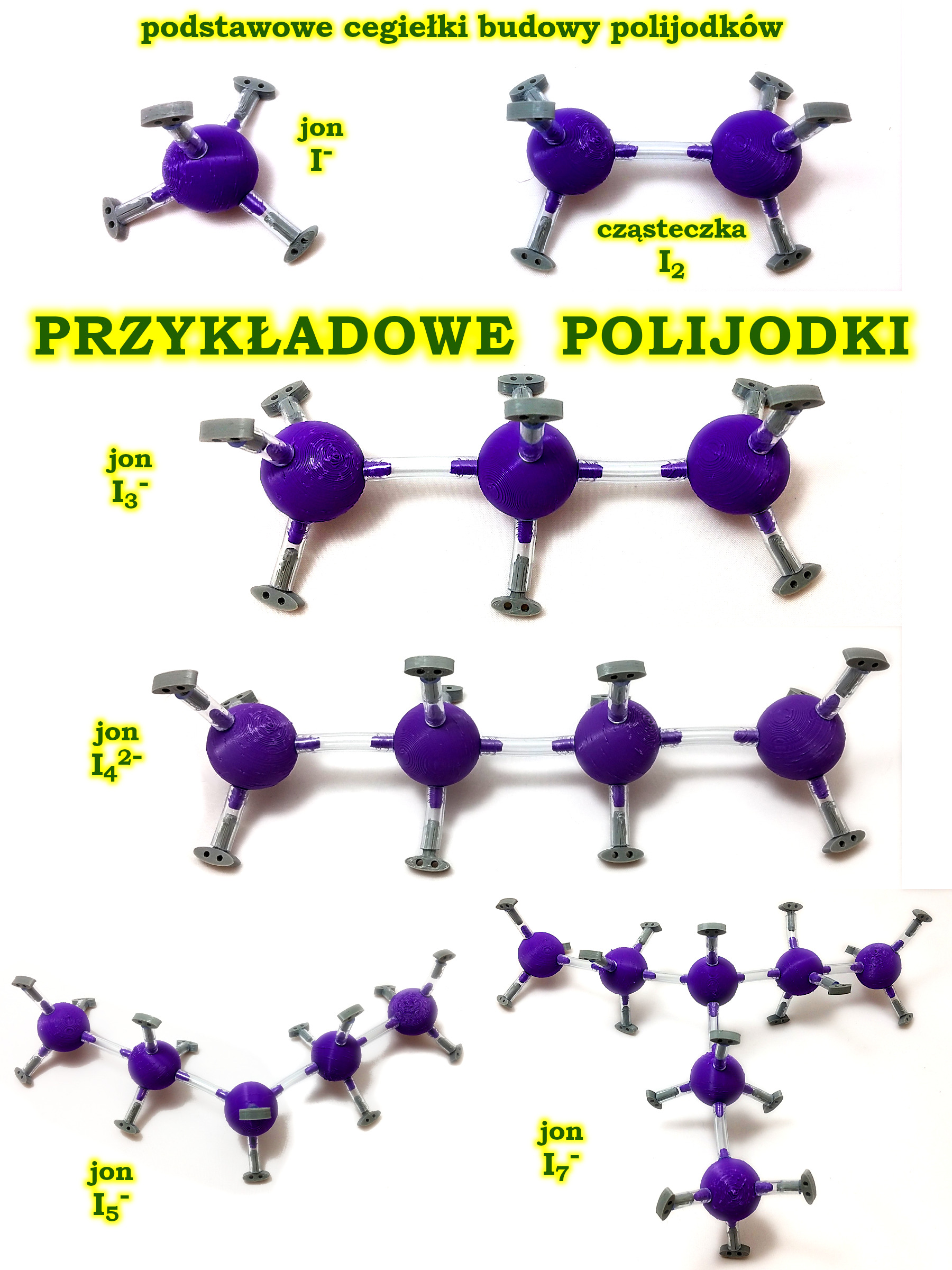
Bardzo wartościowym ćwiczeniem z uczniem liceum jest budowa tych struktur wraz z przeprowadzeniem bilansu elektronowego. Na przykład dla jonu I3- mamy 3∙7 + 1 = 22 elektrony. Zatem tworząc ten jon możemy poza trzema atomami jodu użyć tylko jedenastu wiązań lub par elektronowych. Zastanawiamy się wspólnie z uczniem, które z wiązań jest donorowo-akceptorowe i jakie są ładunki formalne na poszczególnych atomach.
Jeżeli chcesz budować polijodki, to zamów nieorganiczny zestaw Lewisa (umożliwia on zbudowanie jonu I3⁻) i poproś o dołożenie do niego kilku dodatkowych atomów jodu 4,0,0 (tetraedrycznych) oraz 5,0,0 (bipiramidalnych).
Możliwość domawiania pojedynczych elementów do zestawów to unikalna cecha „Atomków”!
Łukasz Aranowski
8 stycznia 2023
__________
źródło: Svensson, P. H., & Kloo, L. (2003). Synthesis, Structure, and Bonding in Polyiodide and Metal Iodide−Iodine Systems. Chemical Reviews, 103(5), 1649–1684.
