PLA – czyli z czego zbudowane są „Atomki”?
Dzisiaj postawimy fundamentalne pytanie. Z czego zrobione są „Atomki”❓ 😊
Artykuł bez problemu zrozumie uczeń szkoły podstawowej z opanowanym pojęciem reakcji estryfikacji i wcześniejszym materiałem klasy ósmej (polimery, alkohole, kwasy karboksylowe). Jest to znakomite uzupełnienie wiedzy o estrach dla uczniów zainteresowanych.
Jednocześnie wiedza o hydroksykwasach, laktydach, laktonach, polikondensacji i poliestrach jest w rozszerzonej podstawie programowej chemii dla szkół średnich.
Kwas mlekowy
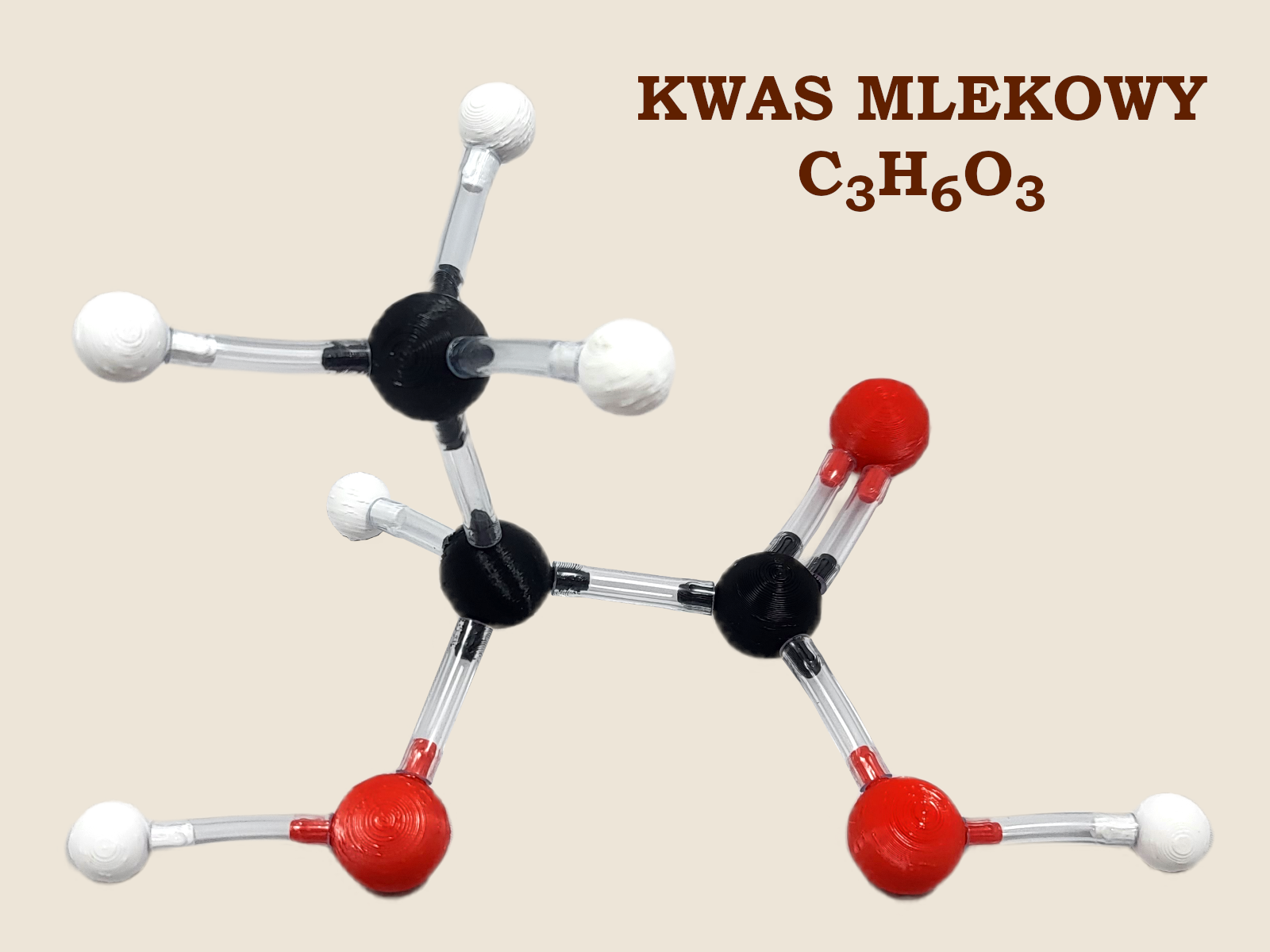
Zacząć musimy od kwasu mlekowego.
To ciekawy kwas karboksylowy, który w swojej cząsteczce posiada również grupę hydroksylową (–OH). Jest to więc kwas i alkohol jednocześnie. Związki takie nazywamy hydroksykwasami. Uczniowie na pewno znają ze słyszenia wiele hydroksykwasów, np.: kwas cytrynowy, kwas jabłkowy, kwas winowy czy kwas salicylowy.
Najprostszy hydroksykwas to kwas glikolowy (kwas hydroksyetanowy). Następny w szeregu jest właśnie kwas mlekowy (kwas 2–hydroksypropanowy). I to na nim się dzisiaj skupimy.
Laktyd kwasu mlekowego (LA)
Omawiając z uczniami ósmej klasy reakcję estryfikacji mówimy, że do jej zajścia konieczna jest grupa karboksylowa (–COOH) oraz hydroksylowa (–OH). A co, jeżeli obie te grupy posiada jedna cząsteczka?
Jeżeli cząsteczka jest dostatecznie duża, a grupy są oddzielone od siebie minimum dwoma atomami węgla, to estryfikacja może zajść w ramach jednej cząsteczki. Powstają w ten sposób związki cykliczne zwane laktonami. Warto z uczniem ułożyć z „Atomków” cząsteczkę γ– lub δ-hydroksykwasu i przekonać się na własne oczy, że taka estryfikacja jest możliwa!
Cząsteczka naszego kwasu mlekowego jest jednak za mała, aby zaszedł taki proces wewnętrznej estryfikacji. Grupa hydroksylowa jest za blisko grupy karboksylowej i wymagałby on zbyt dużych naprężeń w cząsteczce. O tym również można się przekonać budując kwas mlekowy z „Atomków” i próbując wygiąć tę cząsteczkę tak, aby stworzyć lakton. Raczej to się nie uda.
Ale to nie jest powód do zmartwienia! Okazuje się, że w takiej sytuacji na pomoc może pospieszyć druga cząsteczka kwasu mlekowego. Wtedy, w reakcji podwójnej estryfikacji powstają cykliczne cząsteczki zwane laktydami. Choć formalnie laktydy to cała rodzina związków, to laktyd kwasu mlekowego jest tak popularny, że potocznie nazywany jest nieraz po prostu laktydem.
⚠️ Uwaga! ⚠️
Robiąc reakcję estryfikacji z użyciem „Atomków” koniecznie pamiętaj, że atom tlenu w powstającej cząsteczce wody pochodzi z grupy karboksylowej, a nie hydroksylowej. Zatem odrywamy grupę –OH od grupy karboksylowej i atom wodoru –H z grupy hydroksylowej, a nie odwrotnie. Z obu tych fragmentów tworzymy cząsteczkę wody, a pozostałe wolne wiązania łączymy ze sobą przeprowadzając wirtualny proces estryfikacji. Dla końcowego efektu to bez różnicy, ale warto od razu robić to poprawnie, żeby wyrobić sobie dobre nawyki, które przydadzą się w liceum.
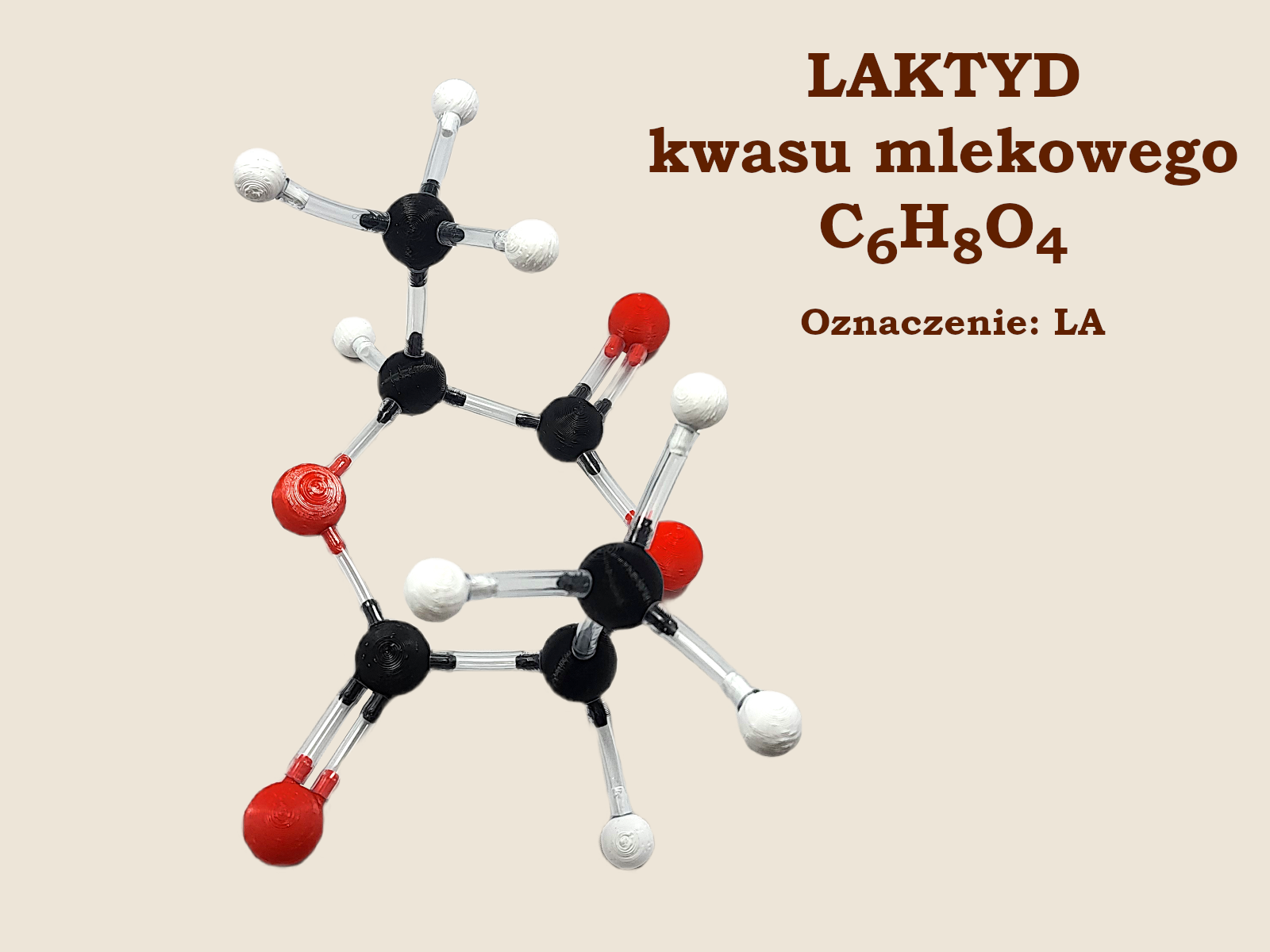
Na koniec rozdziału o laktydzie zróbmy jeszcze mały wtręt dla licealistów. 🧐 Kwas mlekowy ma asymetryczny atom węgla, więc jest chiralny i ma dwa enancjomery: L (o konfiguracji absolutnej S) i D (o konfiguracji absolutnej R). Z tego powodu laktyd ma aż trzy diastereoizomery:
- L,L–LA [(3S)-cis-3,6-dimetylo-l,4-dioksan-2,5-dion],
- D,D–LA [(3R)-cis-3,6-dimetylo-l,4-dioksan-2,5-dion],
- D,L–LA [(3S)-trans-3,6-dimetylo-l,4-dioksan-2,5-dion]
różniące się nieco właściwościami fizycznymi. Na ilustracji przedstawiono laktyd L,L–LA.
Polilaktyd (PLA)
„Atomki” drukowane są na drukarkach 3D z termoplastycznego tworzywa PLA. PLA to skrót od nazwy „polilaktyd”. Jest to więc produkt polikondensacji opisanego wyżej laktydu kwasu mlekowego.
Tutaj drobna dygresja, czym się różni znana uczniom polimeryzacja od polikondensacji.
Procesy te są bardzo podobne do siebie – polegają na łączeniu się wielu pojedynczych cząsteczek (monomerów) w długi łańcuch (polimer). Jednak w procesie polimeryzacji nie powstaje żaden produkt uboczny. Cząsteczki łączą się ze sobą wykorzystując do utworzenia wiązania chemicznego elektrony z wiązania podwójnego obecnego w monomerze. Natomiast polikondensacja polega na budowie długich łańcuchów w oparciu o grupy funkcyjne z wytworzeniem produktu ubocznego – np. cząsteczek wody. A – jak pamiętamy – tak właśnie przebiega reakcja estryfikacji.
Zatem hydroksykwasy polikondensują, zaś produktem tej reakcji są poliestry.
Podobnie robią znane uczniom aminokwasy – polikondensują, zaś produktem są polipeptydy.
PLA jest więc poliestrem.
Struktura i otrzymywanie PLA
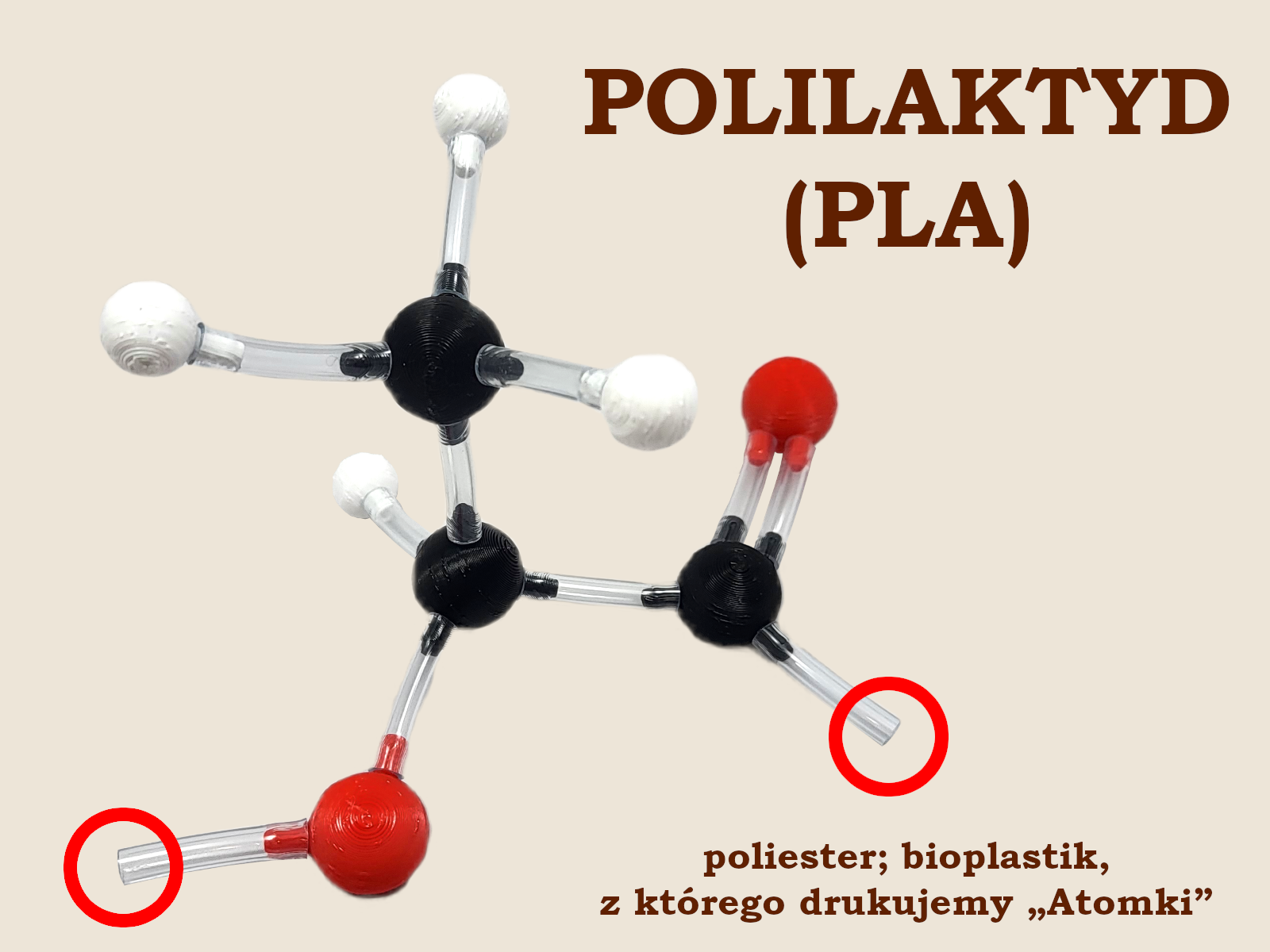
Formalnie rzecz ujmując, monomerem PLA nie jest laktyd, a kwas mlekowy (popatrz na zdjęcie poniżej). Nazwa „polilaktyd” wzięła się stąd, że PLA produkowane jest powszechnie w procesie polimeryzacji laktydu połączonej z katalitycznym otwarciem pierścienia.
Jednak można go otrzymać również w bezpośredniej polikondensacji kwasu mlekowego usuwając wodę w trakcie trwania procesu w celu przesunięcia równowagi reakcji w prawo.
Na zdjęciu na czerwono zaznaczono wiązania, którymi mer polilaktydu łączy się z kolejnymi merami tworząc długie łańcuchy.
☘️ Ekologia ☘️
Produkując dla Was "Atomki” dbamy o naszą planetę. PLA nie tylko jest w pełni biodegradowalny, ale również produkowany z zasobów odnawialnych. Jego monomer – kwas mlekowy – jest wytwarzany ze sfermentowanej skrobi otrzymywanej między innymi z wysłodków buraczanych, czyli z pozostałości z produkcji cukru z buraków cukrowych. Takie ekologiczne tworzywa nazywamy bioplastikami.
PLA jest najczęściej używanym bioplastikiem na świecie. Jego popularność bierze się stąd, że ze względu na niską temperaturę topnienia, wysoką wytrzymałość, niską rozszerzalność cieplną i dobrą przyczepność jest najczęściej stosowanym tworzywem sztucznym w druku 3D.
Układanie struktur
Wszystkie omówione wyżej struktury ułożysz posiadając podstawowy zestaw „Atomków” do chemii organicznej. Korzystając z tego zestawu ułożysz też hydroksykwasy z dłuższymi łańcuchami i grupą hydroksylową przy atomach węgla γ lub δ aby samodzielnie przećwiczyć kondensacje wewnętrzną i powstawanie laktonów.
Z „Atomkami” nauka chemii jest ciekawsza❗
🧐 Zobacz też 🧐
Jeżeli chcesz dowiedzieć się więcej o tworzywach sztucznych, to przeczytaj artykuł o prostych polimerach.
Łukasz Aranowski
5 grudnia 2023
__________
źródło: A. Duda, S. Pęczek „Polilaktyd [poli(kwas mlekowy)]: synteza, właściwości i zastosowania” Polimery 2003, 48, nr 1, 16–26.
