Kwasy siarkowe – czym się różnią?
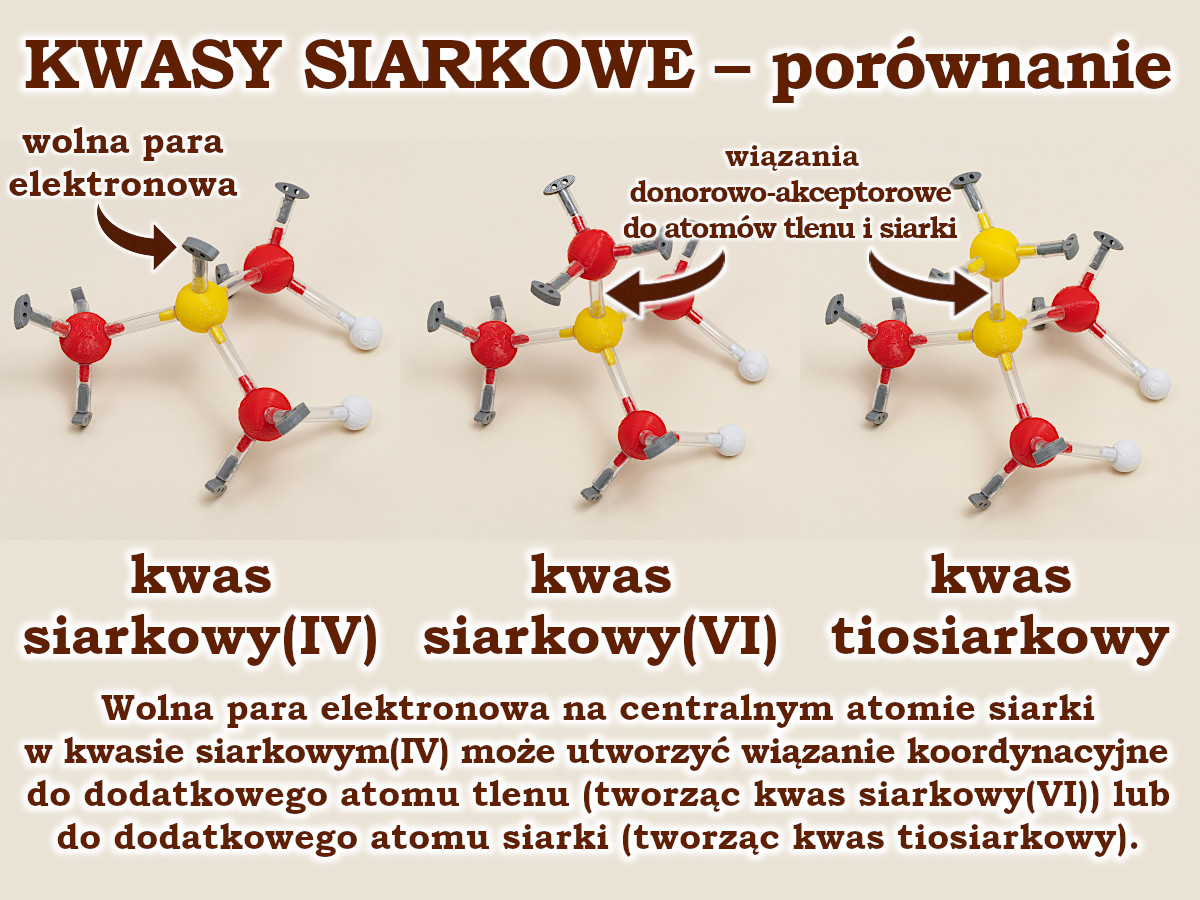
Aby zrozumieć na poziomie licealnym budowę trzech najpopularniejszych kwasów siarkowych, warto zacząć od kwasu siarkowego(IV) (H2SO3). Na centralnym atomie siarki widzimy wolną parę elektronową, która chętnie utworzy wiązanie koordynacyjne.
Jeżeli akceptorem elektronów z tego wiązania będzie atom tlenu, to powstanie cząsteczka kwasu siarkowego(VI) (H2SO4).
Jeżeli zaś będzie to atom siarki, którego liczba elektronów walencyjnych jest identyczna jak atomu tlenu, to powstanie cząsteczka kwasu tiosiarkowego (H2S2O3). Dobrym ćwiczeniem dla uczniów jest ustalenie stopni utlenienia każdego z atomów siarki w tej cząsteczce.
Kwas tiosiarkowy jest niestabilny – w temperaturze pokojowej rozkłada się na siarkowodór i tlenek siarki(VI):
H2S2O3 → H2S + SO3
Natomiast stabilne są jego sole, które wykorzystywane były między innymi w tradycyjnej fotografii lub chemicznej analizie jakościowej.
Wszystkie widoczne na zdjęciu cząsteczki kwasów siarkowych ułożysz dysponując zestawem do chemii nieorganicznej Lewisa.
Łukasz Aranowski
13 grudnia 2022
