Kwas azotowy(III) – ciekawszy niż przypuszczasz
Jednym z kwasów, które nie znajdują się w podstawie programowej dla szkoły podstawowej, ale można go ułożyć z zestawu podstawowego „Atomków” do chemii nieorganicznej jest widoczny na zdjęciu kwas azotowy(III). Jest to substancja bardzo ciekawa, dlatego dzisiaj poświęcimy jej kilka słów.
W artykule o tlenkach azotu szczegółowo opisałem powstawanie tego kwasu. Wprowadzenie do wody równomolowej mieszaniny NO i NO2 powoduje powstanie równowagowych niewielkich ilości N2O3:NO + NO2 ⇄ N2O3
Tlenek ten jest bezwodnikiem kwasu azotowego(III) i reaguje z wodą:N2O3 + H2O → 2HNO2zakłócając równowagę swojej syntezy, co powoduje powstawanie kolejnych jego porcji, które znowu reagują z wodą i tak dalej.
W warunkach laboratoryjnych otrzymuje się go najprościej działając silnym kwasem mineralnym na azotany(III):NaNO2 + HCl → NaCl + HNO2
Kwas azotowy(III) jest nietrwały. Występuje tylko w postaci rozcieńczonych roztworów. W miarę wzrostu stężenia dysproporcjonuje:3HNO2 → HNO3 + 2NO + H2O
Mieszaninę tlenków azotu(II) i azotu(IV) lepiej wprowadzać zatem do roztworów wodorotlenków lub węglanów litowców. Prowadzi to do powstania bardziej trwałych soli tego kwasu – azotanów(III):2NaOH + NO + NO2 → 2NaNO2 + H2ONa2CO3 + NO + NO2 → 2NaNO2 + CO2
Kwas azotowy(III) jest kwasem umiarkowanie słabym (pKa = 3,15).
W obecności silnych utleniaczy HNO2 oraz jego sole są reduktorami. Na przykład, wobec manganianu(VII) potasu zachowują się podobnie jak siarczany(IV) – redukują go w zależności od środowiska reakcji do Mn2+, MnO2 lub MnO42-:2MnO4- + 5NO2- + 6H+ → 2Mn2+ + 5NO3- + 3H2O2MnO4- + 3NO2- + H2O → 2MnO2 + 3NO3- + 2OH-2MnO4- + NO2- + 2OH-→ 2MnO42- + NO3- + H2O
Natomiast wobec reduktorów kwas azotowy(III) przejawia właściwości utleniające. Przykładowo, wypiera jod z jodowodoru:2HI + 2HNO2 → I2 + 2NO + 2H2O
W chemii organicznej wykorzystuje się go jako źródło jonów nitrozoniowych (NO+):HNO2 + H3O+ → NO+ + 2H2Októre reagują z aminami pierwszorzędowym tworząc sole diazoniowe:C6H5NH2 + NaNO2 + 2HCl → [C6H5N2]+[Cl]- + 2H2O + NaCllub drugorzędowymi tworząc oleiste N-nitrozoaminy:(CH3)2NH + NaNO2 + HCl → (CH3)2N–N=O + H2O + NaCl
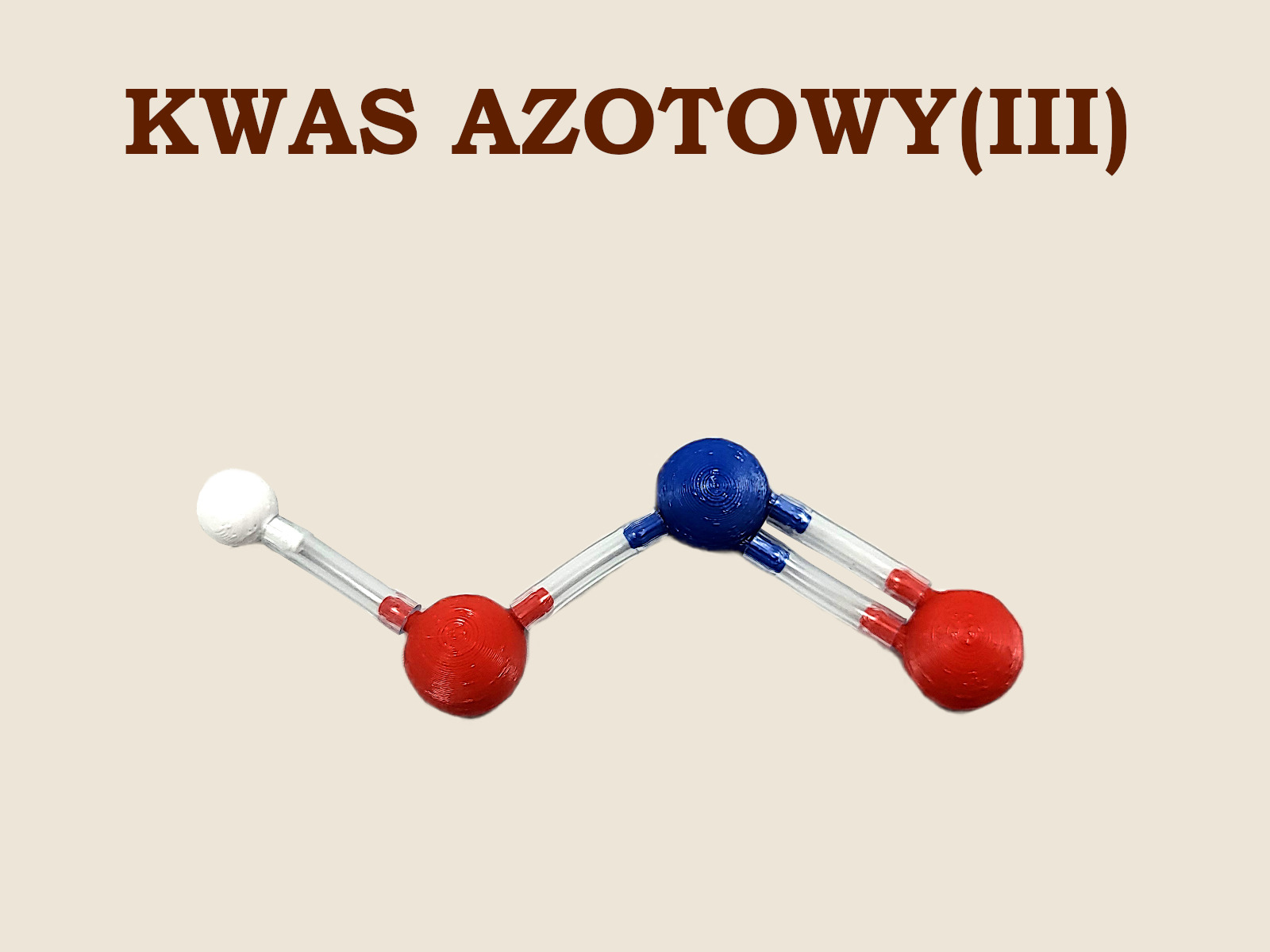
Na powyższym zdjęciu jest cząsteczka omawianego kwasu ułożona z zestawu podstawowego „Atomków” do chemii nieorganicznej. Pracując z uczniami liceum można ułożyć ją korzystając z zestawu Lewisa. Umożliwi to pokazanie i omówienie dwóch konformacji tego kwasu – cis i trans.
Izomer trans, dzięki bliskości atomu wodoru i niewiążącej pary elektronowej na atomie azotu, w bardzo niskich temperaturach może przechodzić w mniej trwały tautomer, w którym atom wodoru jest przyłączony bezpośrednio do atomu azotu – analogicznie jak w kwasie ortoforsoforowym(III):HO–N=O ⇄ H–NO2
Korzystając z zestawu Lewisa możemy też ułożyć sam jon azotanowy(III). Po jego ułożeniu naprowadzamy uczniów na fakt, że jest on izoelektronowy z cząsteczką ozonu, a zatem ma identyczną budowę.
❓ Czy wiesz, że... ❓
Na zdjęciu jest tylko jedna cząsteczka – głównego bohatera tego wpisu. Jednak wszystkie, nawet najbardziej skomplikowane cząsteczki i jony występujące w tym tekście, ułożysz posiadając zestawy „Atomków” Lewisa do chemii nieorganicznej i organicznej. To jedyne zestawy, które tak wiernie pozwalają odtwarzać rzeczywistość.
Łukasz Aranowski
26 listopada 2023
