Wiązania kowalencyjne
na przykładzie cząsteczek wody i dwutlenku węgla
część 2 z 3
Kontynuujemy nasz cykl o wiązaniach kowalencyjnych dla siódmoklasistów. Jeżeli nie przeczytałeś części pierwszej o dwuatomowych cząsteczkach pierwiastków, to koniecznie zrób to przed lekturą tego wpisu.
Dzisiaj skupimy się na dwóch tlenkach, które podstawa programowa wymienia wśród ośmiu substancji, których wzory sumaryczne i strukturalne uczeń szkoły podstawowej musi umieć. Omówimy budowę tych cząsteczek w sposób zrozumiały dla ucznia, który opanował już powłokową konfigurację elektronową pierwiastków.
Zapraszamy zatem do części drugiej o tlenkach niemetali.
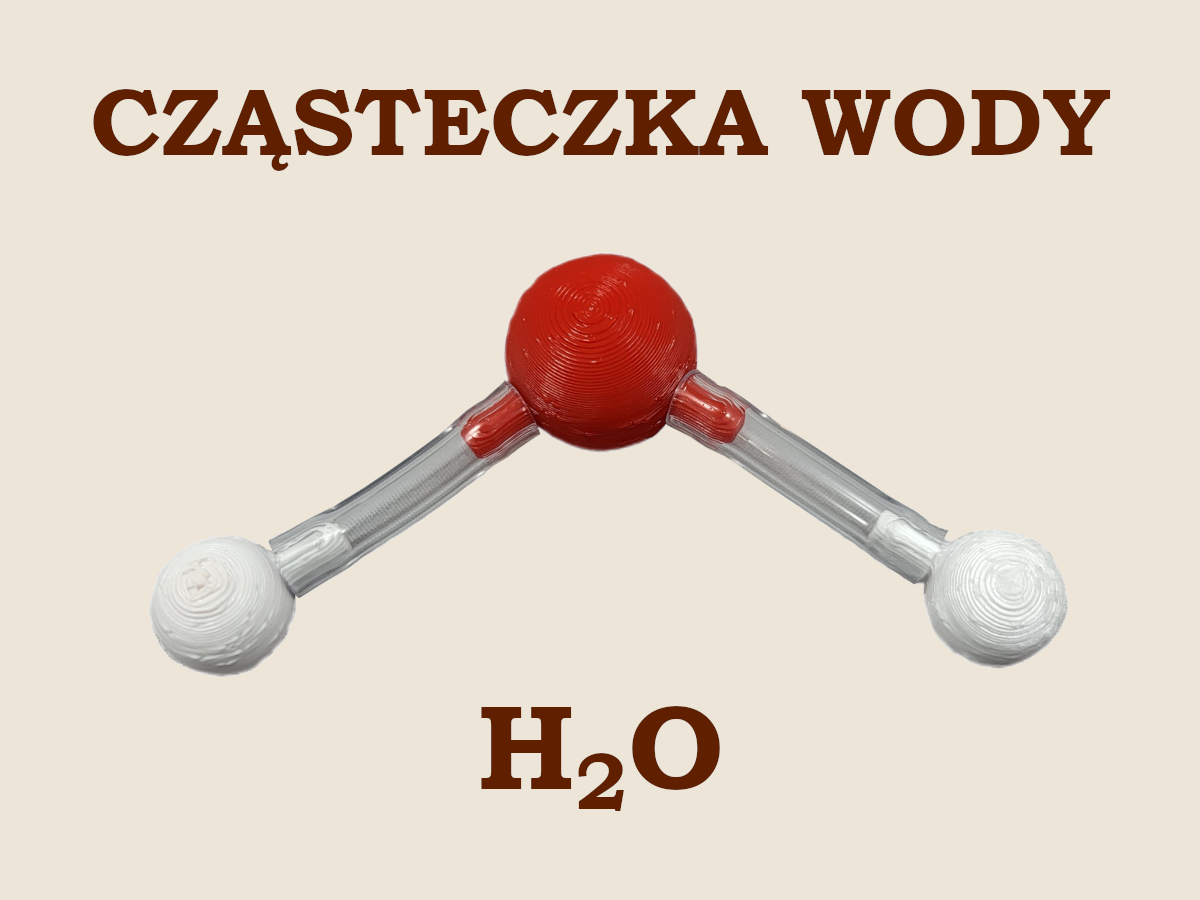
🧪 H2O, cząsteczka wody
Konfigurację elektronową atomów tlenu i wodoru omówiliśmy w części pierwszej. Przypomnijmy, że atom tlenu do uzyskania oktetu elektronowego (czyli konfiguracji elektronowej najbliższego gazu szlachetnego – neonu) potrzebuje dwóch elektronów, a atomy wodoru do uzyskania dubletu elektronowego (czyli konfiguracji elektronowej najbliższego gazu szlachetnego – helu) – po jednym elektronie. Dlatego atom tlenu uwspólnia po jednym elektronie z dwoma atomami wodoru. Sam otrzymuje dzięki tej operacji dwa dodatkowe elektrony, a każdy z atomów wodoru otrzymuje po jednym dodatkowym elektronie. Mówimy, że atom tlenu kowalencyjnymi wiązaniami pojedynczymi przyłącza dwa atomy wodoru tworząc cząsteczkę wody H—O—H.
Tym razem nasza cząsteczka składa się z atomów różnych pierwiastków, więc pozostaje jeszcze kwestia polaryzacji wiązania. Różnica elektroujemności pomiędzy tlenem i wodorem wynosi 1,24 i z tego powodu wiązania pomiędzy tymi atomami są dosyć silnie spolaryzowane. Pary elektronów tworzące te wiązania są wyraźnie przesunięte w kierunku atomu tlenu. Powoduje to powstanie na atomie tlenu cząstkowego ładunku ujemnego, a na atomach wodoru cząstkowego ładunku dodatniego. Taki układ dwóch rozdzielonych przeciwnych ładunków równych co do wartości fizycy nazywają dipolem.
W warunkach normalnych woda jest bezbarwną i bezwonną cieczą. Stanowi rozpuszczalnik dla bardzo wielu substancji, również organicznych, przez co jest podstawą życia na Ziemi.
🧪 CO2, cząsteczka tlenku węgla(IV)
Aby wyjaśnić budowę cząsteczki tlenku węgla(IV) (zwyczajowo: dwutlenku węgla) musimy rozpisać konfigurację atomów węgla oraz tlenu. Węgiel posiada na ostatniej powłoce cztery elektrony: K2 L4, a tlen sześć: K2 L6. Aby osiągnąć oktet elektronowy atom węgla potrzebuje więc aż czterech dodatkowych elektronów, a tlen – dwóch dodatkowych elektronów. Pamiętamy, że chcąc uwspólnić elektrony, do puli należy włożyć tyle samo elektronów, ile chce się uzyskać. Dlatego atom węgla „oferuje” cztery elektrony, a atomy tlenu po dwa. Jeden atom węgla przyłącza więc dwa atomy tlenu, z każdym uwspólniając po dwa elektrony. Tym sposobem powstają dwa kowalencyjne wiązania podwójne O=C=O.
Ponieważ różnica elektroujemności pomiędzy tlenem i węglem wynosi 0,89, to wiązania te także są spolaryzowane (choć nie tak silnie jak w omówionej wyżej cząsteczce wody). Elektrony tworzące te wiązania są przesunięte w kierunku atomów tlenu.
W temperaturze pokojowej dwutlenek węgla jest bezbarwnym i bezwonnym gazem. Jako produkt metabolizmu komórek stanowi około 4% wydychanego przez nas powietrza. W wysokich stężeniach jest dla nas trujący.

Informacje dodatkowe
Aby zbudować wszystkie powyższe cząsteczki siódmoklasista powinien posiadać zestaw podstawowy (stuelementowy) do chemii nieorganicznej.
Niedługo pojawi się trzecia i ostatnia część serii omawiającej powstawanie wiązań chemicznych na przykładzie prostych związków. Polub fanpejdż „Atomków” na Fejsbuku aby tego nie przegapić!
🧐 Zobacz też 🧐
Wszystkie artykuły cyklu o wiązaniach kowalencyjnych:
- Wiązania kowalencyjne – na przykładzie cząsteczek wodoru, chloru, tlenu i azotu (część 1 z 3),
- Wiązania kowalencyjne – na przykładzie cząsteczek wody i dwutlenku węgla (część 2 z 3) ← tu jesteś,
- Wiązania kowalencyjne – na przykładzie cząsteczek chlorowodoru, wody, amoniaku i metanu (część 3 z 3).
Łukasz Aranowski
13 lutego 2024
