Układ woda‑etanol
potężny efekt wiązań wodorowych
Dzisiaj pokażemy Wam do jak ciekawych rozważań można dojść budując z „Atomków” agregaty cząsteczek połączonych wiązaniami wodorowymi.
Mieszanina alkoholu etylowego z wodą
Mieszanina etanolu z wodą jest w szkole średniej omawiana z kilku przyczyn. W czasie mieszania tych dwóch substancji występują trzy ciekawe zjawiska:
- mieszają się one w dowolnych proporcjach,
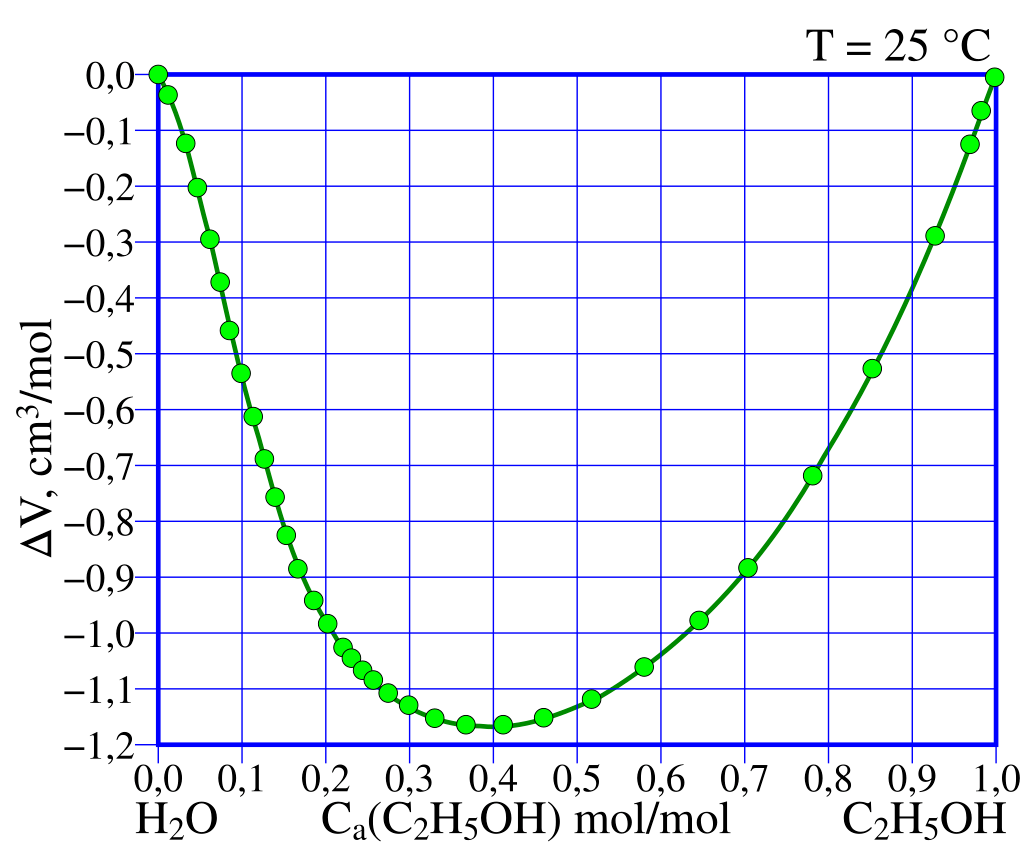
- w czasie mieszania następuje kontrakcja objętości(*),
- przy stężeniu wagowym 95% etanolu powstaje mieszanina azeotropowa.
Wiązania wodorowe w układzie woda‑etanol
Przyczyną dwóch pierwszych zjawisk jest tworzenie się agregatów cząsteczek wody i etanolu połączonych wiązaniami wodorowymi. Spróbujmy ułożyć taki najprostszy agregat jednej cząsteczki wody i jednej cząsteczki etanolu z „Atomków”. Niezbędny nam do tego będzie zestaw Lewisa do chemii organicznej wraz z dodatkiem „wiązania wodorowe”.
W czasie układania natychmiast powstaje pytanie. Który atom tlenu będzie donorem pary elektronowej? Czy ten należący do cząsteczki etanolu, czy ten należący do cząsteczki wody? Możliwe więc są dwa heterodimery agregatu cząsteczek woda‑etanol.
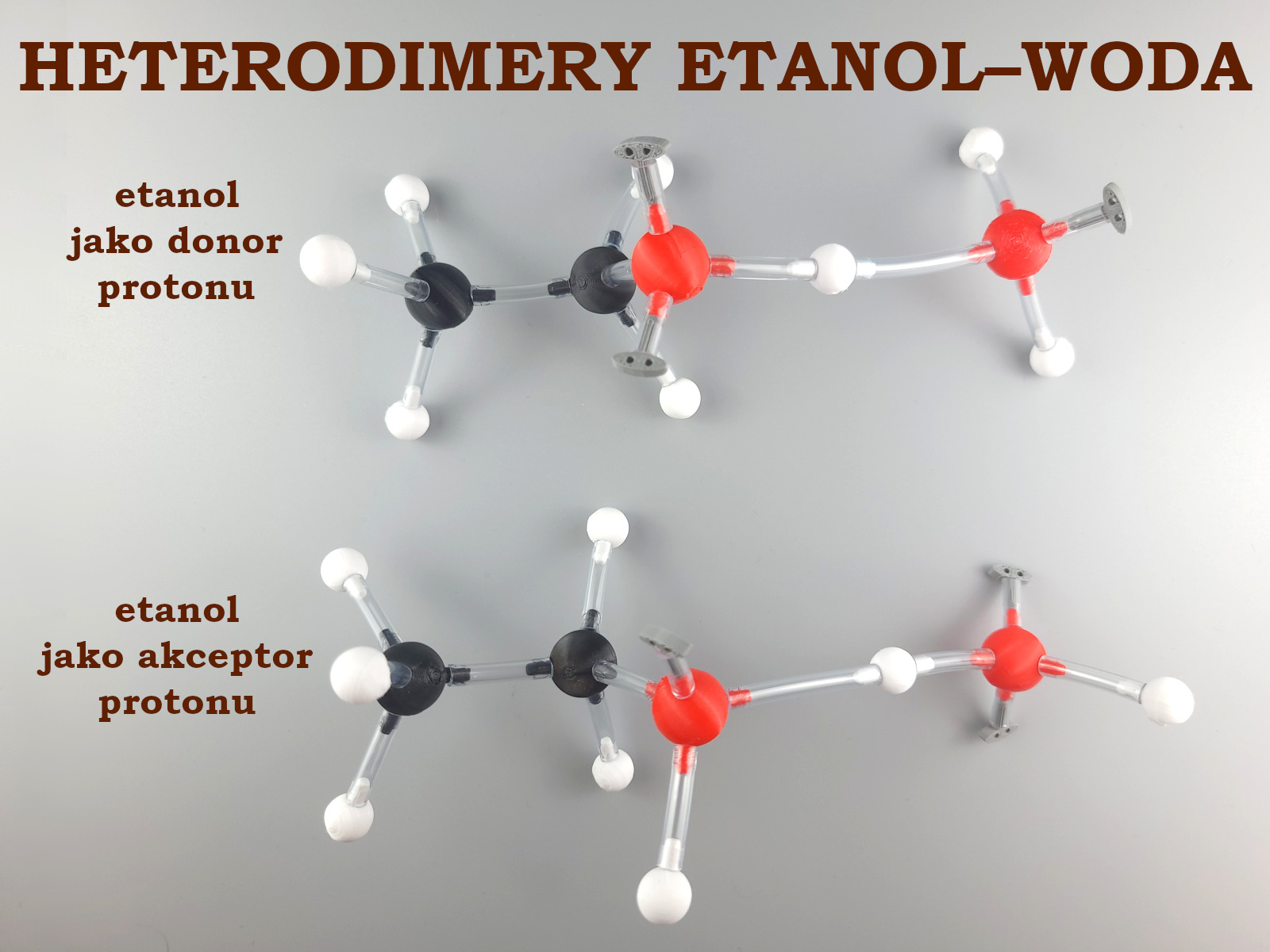
Okazuje się, że odpowiedź na pytanie, która z tych form jest dominująca nie jest jednoznaczna. W dodatku eksperymenty wykazują istnienie większych agregatów, których struktury są silnie zależne od stężenia, temperatury, a nawet mieszania roztworu.
Większe klastry cząsteczek wody i etanolu
Szczegółowe badania i symulacje komputerowe potwierdziły istnienie bardzo dużych klastrów cząsteczek wody i etanolu.
Na ilustracji poniżej widzicie takie klastry przy ułamku molowym(**) etanolu: 0,4 (po lewej), 0,7 (w środku) i 0,9 (po prawej stronie). Czerwone kropki symbolizują cząsteczki etanolu, zielone – wody, a linie pomiędzy nimi to wiązania wodorowe.
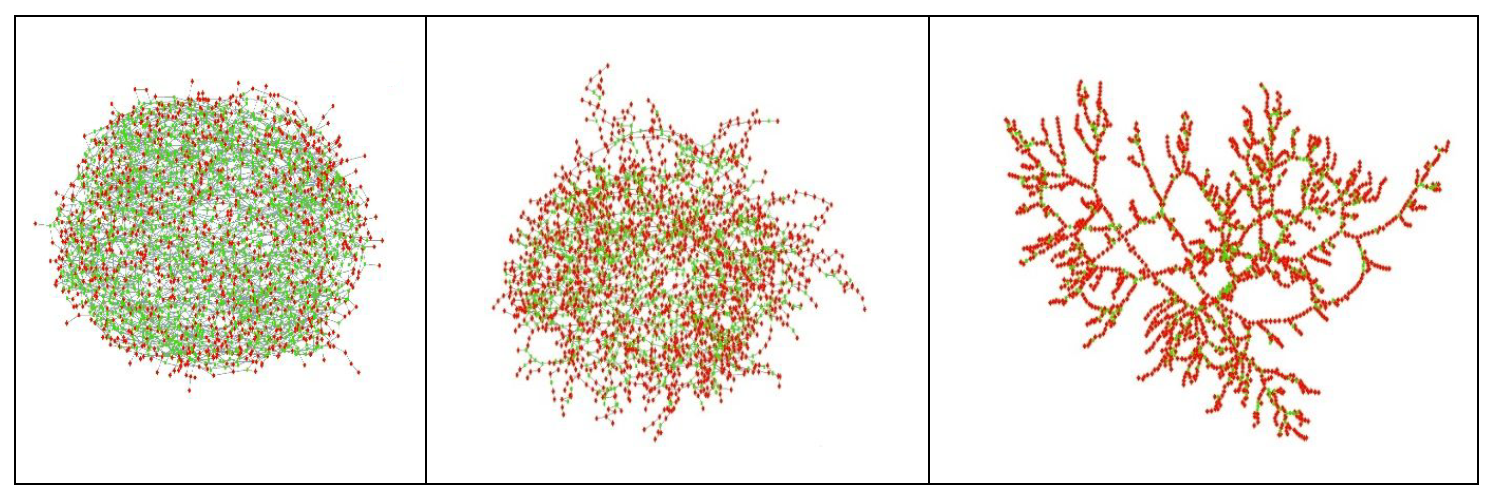
Przyjrzyjmy się lewej strukturze. Przedstawia ona układ najbardziej korzystny przestrzennie. To właśnie przy tych proporcjach – czterech cząsteczek etanolu na sześć cząsteczek wody – układ charakteryzuje się największą kontrakcją objętości.
Bardzo ciekawie zachowuje się etanol o bardzo niskich stężeniach w wodzie. Przy ułamku molowym etanolu rzędu 0,07 tworzą się klastry złożone z cząsteczki etanolu uwięzionej w klatce molekuł wody.
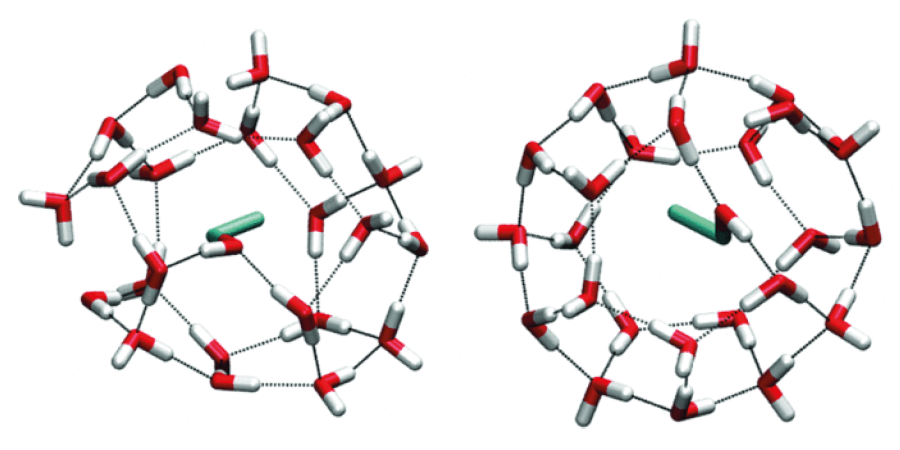
Co ciekawe, badania wykazują, że nawet przy tak małych stężeniach etanol zachowuje się jak... mydło. Często bowiem w tych „klatkach wodnych” uwięzionych jest nie jedna, a kilka cząsteczek etanolu, w których grupy węglowodorowe (hydrofobowe) zwrócone są do środka, a grupy hydroksylowe (hydrofilowe) na zewnątrz. W tych asocjatach grupy węglowodorowe połączone są słabymi oddziaływaniami van der Waalsa. Całość zaś otoczona jest przez cząsteczki wody połączone ze sobą oraz z grupami hydroksylowymi cząsteczek etanolu wiązaniami wodorowymi.
Oznacza to, że mieszanie się alkoholu etylowego z wodą nigdy nie jest idealne i na poziomie molekularnym występują niejednorodności wynikające z asocjacji cząsteczek etanolu.
Podsumowanie
Przyczyną tak znakomitej mieszalności wody i etanolu jest fakt istnienia mniejszych i większych agregatów tych cząsteczek. Dla każdego stężenia te struktury różnią się od siebie, jednak zawsze układ taki jest trwały.
Łukasz Aranowski
15 września 2024
Przypisy
(*) Kontrakcja objętości to zjawisko zmniejszenia sumarycznej objętości roztworu w czasie mieszania dwóch składników.
(**) Ułamek molowy to jeden ze sposobów na wyrażenie stężenia. Zdefiniowany jest jako stosunek liczby moli składnika, do liczby moli wszystkich składników mieszaniny. Np. ułamek molowy etanolu w wodzie o wartości 0,4 oznacza, że 40% wszystkich cząsteczek w układzie stanowi etanol, czyli proporcja cząsteczek etanolu do wody wynosi 4:6.
Źródła
👉 Piotr Janko (Główny Urząd Miar), „Budowa układu konfekcjonowania certyfikowanych materiałów odniesienia w postaci wodnych roztworów etanolu do opakowań jednostkowych”, Technika i pomiary, 2019, 2, s. 17-23.
👉 Stehle S. i Braeuer A. S., “Hydrogen Bond Networks in Binary Mixtures of Water and Organic Solvents”, J. Phys. Chem. B, 2019, 123, s. 4425-4433.
👉 Nishi N. i in., “Hydrogen-Bonded Cluster Formation and Hydrophobic Solute Association in Aqueous Solutions of Ethanol”, J. Phys. Chem., 1995, 99(1), s. 462-468.
👉 Pothoczki Sz. i in. “Properties of Hydrogen-Bonded Networks in Ethanol–Water Liquid Mixtures as a Function of Temperature: Diffraction Experiments and Computer Simulations”, J Phys Chem B., 2021, 125(23), s. 6272–6279.
