Mocznik – kompendium olimpijczyka
Mocznik to jedna z najważniejszych substancji bioorganicznych. Umożliwia on pozbycie się z organizmu nadmiaru azotu, dzięki czemu nasze ciało może metabolizować białka. Ale na tym zalety mocznika się nie kończą! Jego synteza w pierwszej połowie XIX wieku wprowadziła niemały zamęt i obaliła pewną teorię funkcjonującą od starożytności. Jest to również substancja o ogromnej liczbie zastosowań praktycznych.
Niestety, obecny system edukacyjny niemal zupełnie pomija tą substancję.
W szkole podstawowej mocznik jest tylko wspomniany na lekcjach biologii jako jedna z substancji wydalanych przez organizm człowieka. I jest to ostatnia wzmianka o tym związku w aktualnej podstawie programowej. Do niedawna był on jeszcze omawiany w liceum – na lekcjach biologii i chemii. Jednak po zmianach w podstawie programowej w 2024 mocznik został usunięty z programu nauczania w szkole średniej – zarówno na lekcjach chemii, jak i biologii. Lecz jest to substancja tak ważna i tak dydaktycznie bogata w ciekawe treści, że nie można nic o niej nie wiedzieć.
Nasz artykuł ma ambicję, aby pokazać tę substancję oraz jej role biologiczną i chemiczną całościowo i rzetelnie. Przy okazji będzie to znakomity pretekst do poznania nowych struktur i reakcji chemicznych.
Struktura mocznika
W jednym z poprzednich artykułów wprowadziliśmy pojęcie amidu kwasowego. Przypomnijmy: amid kwasowy powstaje, gdy grupę hydroksylową (–OH) tlenowego kwasu nieorganicznego lub kwasu karboksylowego zastąpimy grupą aminową (–NH2).
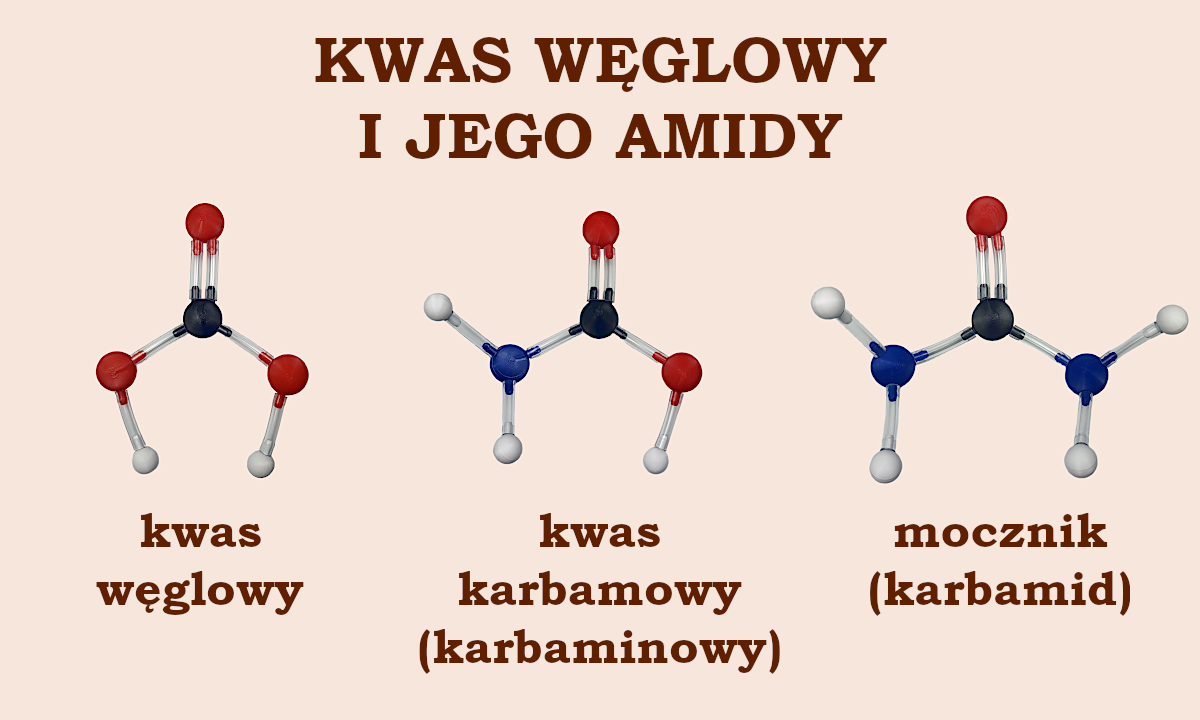
Spróbujmy utworzyć amid znanego każdemu uczniowi podstawówki kwasu węglowego. Choć sam kwas węglowy (H2CO3) jest skrajnie nietrwały, to trwałe są jego dwupodstawione pochodne – znany nam już dichlorek, czyli fosgen, który opisywaliśmy w artykule o gazach bojowych oraz diamid, czyli właśnie mocznik.
Jednak chemicy wolą uważać mocznik za pochodną równie nietrwałego co kwas węglowy kwasu karbamowego (karbaminowego). Kwas karbamowy ze strukturalnego punktu widzenia to monoamid kwasu węglowego. Jednak, ponieważ zawiera grupę karboksylową, to traktowany jest jako kwas organiczny. Zatem jego pochodna – mocznik – również strukturalnie musi być traktowana jako związek organiczny. Traktowanie mocznika jako amidowej pochodnej kwasu karbamowego ma odzwierciedlenie w jego drugiej nazwie: karbamid.
Wszystkie wymienione wyżej cząsteczki – kwasu węglowego i jego pochodnych – ułożysz posiadając stuelementowy zestaw „Atomków” do chemii organicznej dla szkoły podstawowej.
Otrzymywanie mocznika
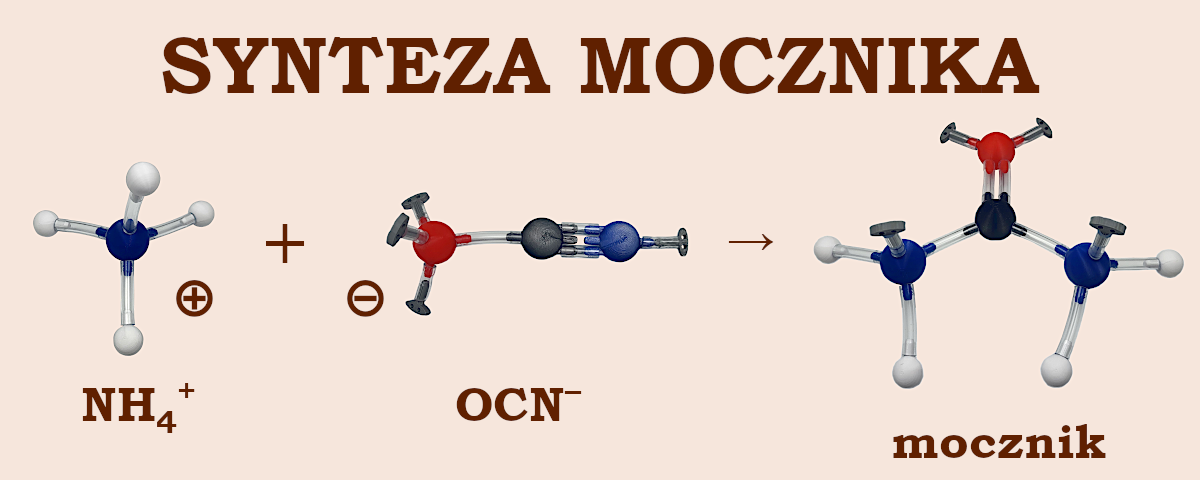
Mocznik zapisał się w historii chemii faktem, że był to pierwszy związek organiczny, który zsyntetyzowano używając wyłącznie substratów nieorganicznych. Obaliło to funkcjonującą od starożytności teorię „siły witalnej” (łac. vis vitalis), zakładającej, że substancje organiczne (z których zbudowane są istoty żywe) mogą powstać wyłącznie pod wpływem niematerialnej i niefizycznej „siły życiowej”.
W 1828 Friedrich Wöhler otrzymał mocznik w wyniku ogrzewania mieszaniny cyjanianu srebra i chlorku amonu. Widoczną na ilustracji reakcję pomiędzy jonami cyjanianowym i amonowym ułożysz posiadając zestawy dla szkół średnich (Lewisa) do chemii nieorganicznej (cyjanian amonu) i organicznej (mocznik).
Przemysłowo mocznik otrzymuje się w tzw. procesie mocznikowym Boscha-Meisera. Składa się on z dwóch reakcji równowagowych. Pierwszą z nich jest szybka egzotermiczna reakcja ciekłego amoniaku z gazowym dwutlenkiem węgla w wysokiej temperaturze i ciśnieniu z wytworzeniem karbaminianu amonu:
2NH3 + CO2 → NH4CO2NH2
Druga reakcja to powolny endotermiczny rozkład karbaminianu amonu:
NH4CO2NH2 → CO(NH2)2 + H2O
Ogólnie synteza mocznika jest egzotermiczna, a ciepło wytworzone w pierwszej reakcji napędza drugą.
Właściwości chemiczne mocznika
Mocznik znakomicie rozpuszcza się w wodzie. Jest to jednak reakcja endotermiczna – rozpuszczanie mocznika w wodzie powoduje oziębienie mieszaniny. Wynika to z faktu, że wiązania wodorowe mocznik‑mocznik są silniejsze niż woda‑mocznik.
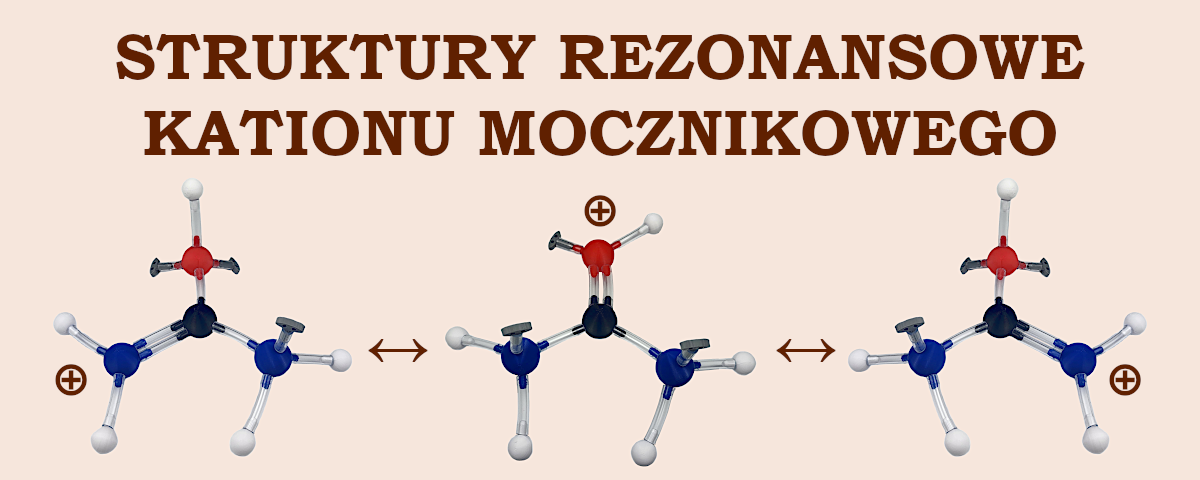
Wodny roztwór mocznika jest obojętny. Jest tak, gdyż amidy nie wykazują charakteru zasadowego z powodu przesunięcia wolnej pary elektronowej z atomu azotu w kierunku atomu tlenu w grupie karbonylowej. W wyniku tego w dużej części tracą one zdolność przyłączania protonu. Mimo tego zjawiska mocznik wykazuje pewien charakter zasadowy – silniejszy niż inne amidy. Może więc tworzyć sole. Jest on, oczywiście, zasadą dużo słabszą niż woda (pKb = 13,9).
Mocniejszy niż w przypadku innych amidów zasadowy charakter mocznika spowodowany jest faktem, że po przyłączeniu protonu (do atomu tlenu, a nie azotu!) kation mocznikowy jest dodatkowo stabilizowany przez efekty rezonansowe. Nasz zestaw Lewisa do chemii organicznej dla szkół średnich to jedyny zestaw na polskim rynku, za pomocą którego możesz wiernie odtworzyć te struktury graniczne.
Przykładem soli mocznikowej jest azotan(V) mocznika, który jest silnym materiałem wybuchowym:
NH2CONH2 + HNO3 → [NH2CONH3]+ NO3–
Mocznik, podobnie jak inne amidy, ulega hydrolizie pod wpływem:
🧪 kwasów: (NH2)2CO + H2O+ 2H+ → 2NH4+ + CO2
🧪 zasad: (NH2)2CO + 2OH– → 2NH3 + CO32–
oraz enzymu ureazy wytwarzanego przez wiele bakterii (m in.: glebowych, o czym piszemy dalej):
(NH2)2CO + H2O → 2NH3 + CO2
W wyniku działania na mocznik chlorkami lub bezwodnikami kwasowymi otrzymuje się ureidy:
(NH2)2CO + CH3COCl → CH3CONHCONH2 + HCl
Szczególne znaczenie miały ureidy cykliczne zwane barbituranami, które otrzymywane są w reakcji mocznika z estrem kwasu malonowego. Są one silnymi środkami nasennymi. Niestety, mają one także działanie silnie uzależniające, dlatego wycofano się z ich stosowania.
Biologiczne znaczenie mocznika
Choć na biologii uczymy się, że białka są przede wszystkim budulcem dla organizmu, to wiele białek – szczególnie tych uszkodzonych lub niepoprawnie zwiniętych – musi ulec degradacji. W pierwszym rzędzie są one rozbijane na aminokwasy.
 Część aminokwasów zużywanych jest jako budulec dla nowych białek lub jako substrat do syntezy innych związków zawierających azot (na przykład: zasad azotowych w nukleotydach lub niektórych hormonów – koniecznie przeczytaj nasz artykuł o syntezie melatoniny z tryptofanu). Nadmiarowa część aminokwasów musi ulec dalszemu przetworzeniu, gdyż w odróżnieniu od glukozy i kwasów tłuszczowych, nie mogą być one przechowywane. Kierowane są więc do komórek, które wykorzystują je jako paliwo.
Część aminokwasów zużywanych jest jako budulec dla nowych białek lub jako substrat do syntezy innych związków zawierających azot (na przykład: zasad azotowych w nukleotydach lub niektórych hormonów – koniecznie przeczytaj nasz artykuł o syntezie melatoniny z tryptofanu). Nadmiarowa część aminokwasów musi ulec dalszemu przetworzeniu, gdyż w odróżnieniu od glukozy i kwasów tłuszczowych, nie mogą być one przechowywane. Kierowane są więc do komórek, które wykorzystują je jako paliwo.
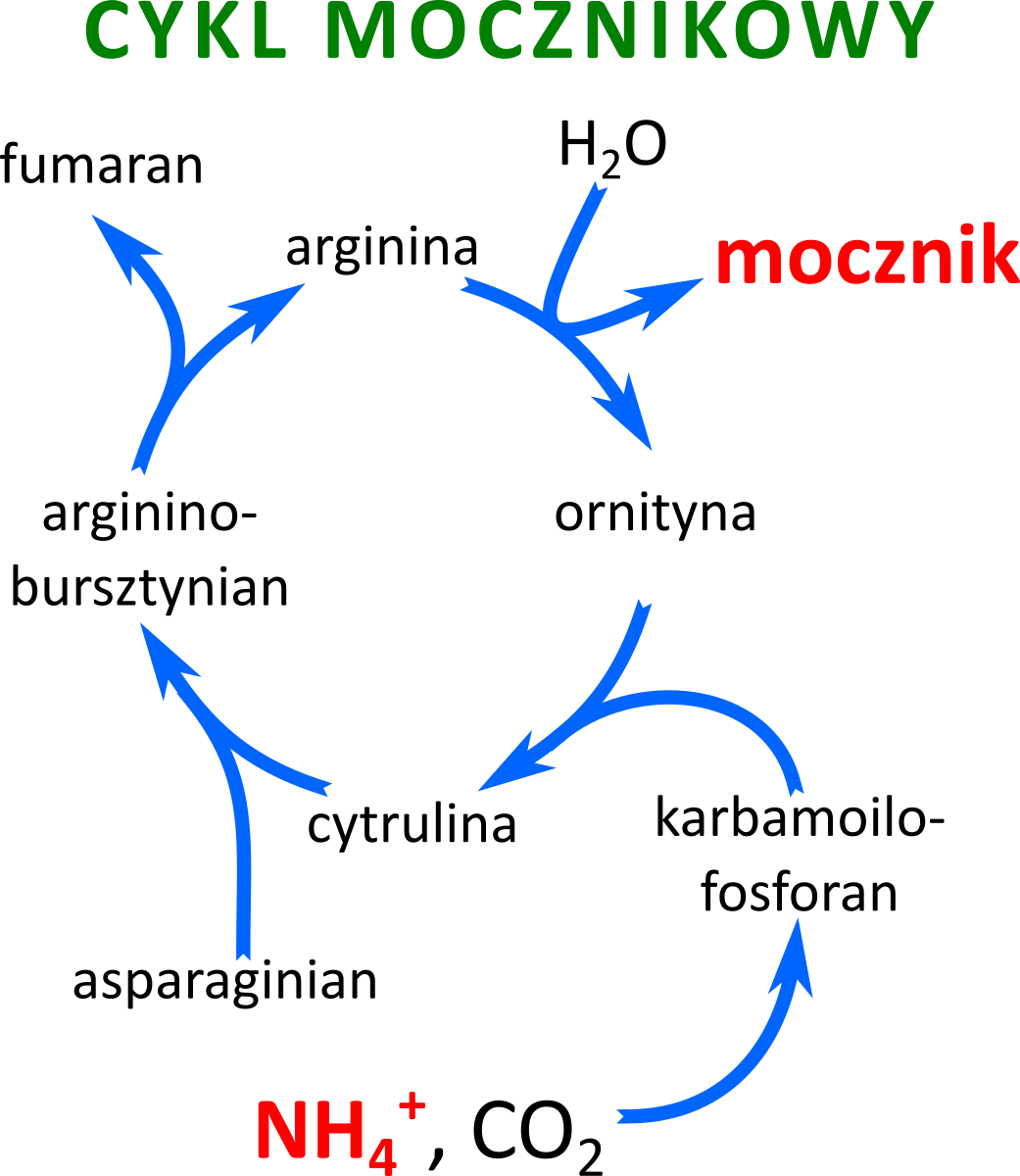
Pierwszym krokiem w degradacji aminokwasu przez komórkę jest odłączenie grupy α‑aminowej w procesie deaminacji. Pozostały szkielet węglowy (ketokwas) jest przetwarzany dalej, a powstający toksyczny jon amonowy (NH4+) jest przekształcany w alaninę lub glutaminę i transportowany przez krew do wątroby. Tam substancje te są ponownie rozbijane w celu uzyskania wolnego jonu amonowego, który w tzw. cyklu mocznikowym (patrz: schemat) przekształcany jest na mocznik. Mocznik wydalany jest z organizmu z moczem i w pewnej niewielkiej części z potem.
Na koniec tej części warto przytoczyć pewną ciekawostkę. W opisany wyżej sposób działa usuwanie nadmiaru azotu u większości kręgowców lądowych (tzw. organizmy ureoteliczne). Ale wydalanie nadmiaru azotu za pomocą mocznika to nie jedyny sposób, jaki „wymyśliła” przyroda. Organizmy amonioteliczne, głównie wodne kręgowce i bezkręgowce, wydalają azot bezpośrednio w postaci jonu amonowego wykorzystując szeroką dostępność wody do rozcieńczania tej toksycznej substancji. Natomiast organizmy żyjące w środowiskach suchych, takie jak gady czy ptaki, wydalają azot w postaci papki zawierającej kwas moczowy (C5H4N4O3). Są to tzw. organizmy urykoteliczne.
Zastosowania mocznika
W laboratorium
W laboratoriach chemii organicznej mocznik jest często substratem służącym do syntezy bardziej skomplikowanych związków. Najprostszym przykładem jest kondensacja mocznika do biuretu pod wpływem ogrzewania:
NH2CONH2 → NH2CONHCONH2 + NH3
Służy też do pozbywania się z mieszaniny reakcyjnej nadmiaru kwasu azotowego(III) w reakcjach dwuazowania:
(NH2)2CO + 2HNO2 → 2N2 + CO2 + H2O
W systemach samochodowych
Mocznik stosowany jest jako bezpieczne źródło amoniaku niezbędnego do redukcji tlenków azotu pochodzących ze spalania paliwa w silnikach wysokoprężnych. Stosowane systemy najczęściej wstrzykują do układu wydechowego wodny roztwór mocznika, gdzie mocznik ulega hydrolizie do amoniaku. Dalsza reakcja może być opisana uproszczonym równaniem sumarycznym:
4NO + 4NH3 + O2 → 4N2 + 6H2O
W medycynie
40‑procentowy roztwór mocznika jest składnikiem kremów nawilżających skórę stosowanych w dermatologicznym leczeniu łuszczycy, grzybicy paznokci, egzemy, rogowacenia oraz odcisków.
W przemyśle drzewnym
Mocznik reaguje z formaldehydem tworząc usieciowane polimery z grupy aminoplastów – tzw. żywice mocznikowo‑formaldehydowe. Dokładny przebieg tych reakcji pokazaliśmy na schemacie poniżej.
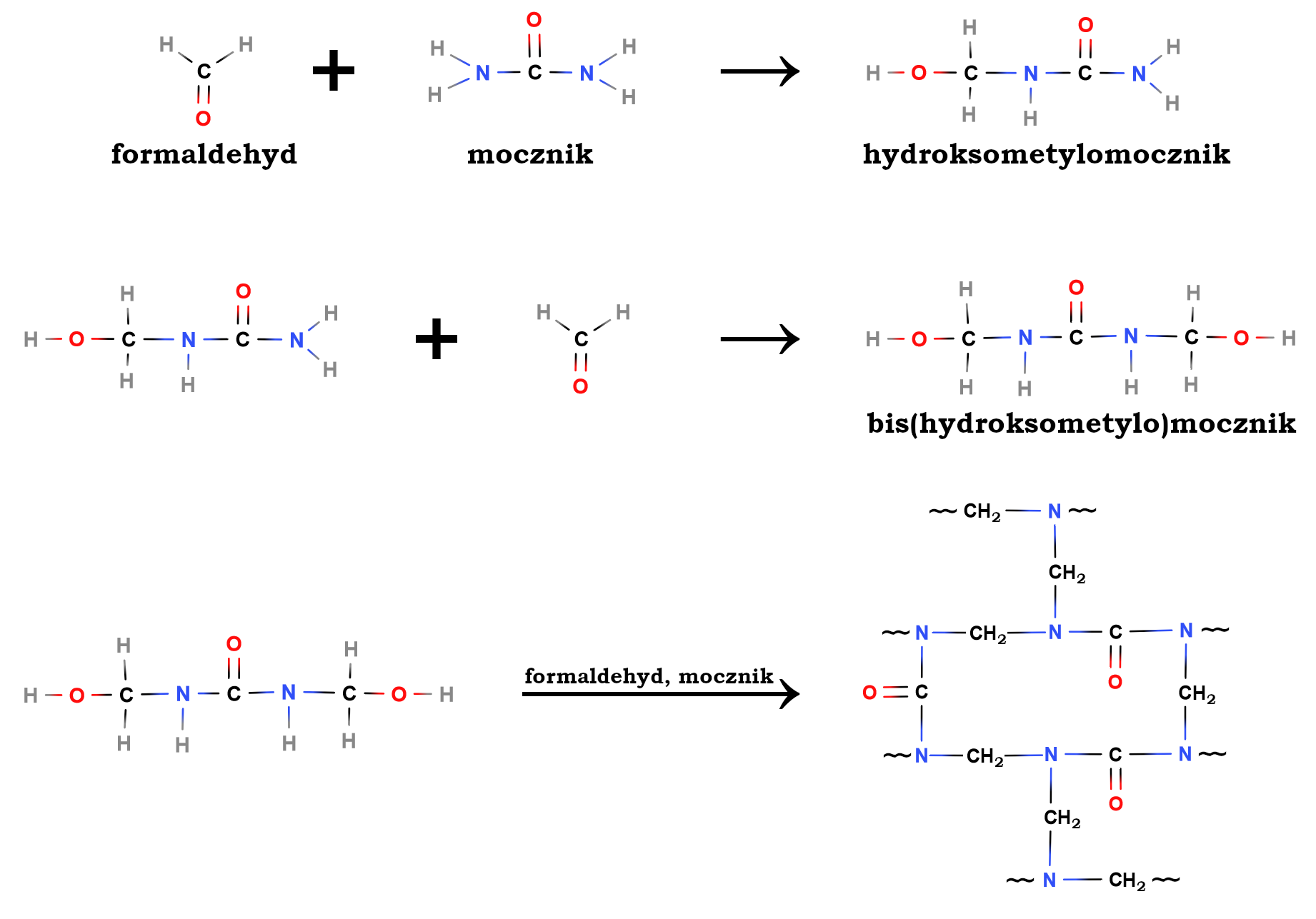
Większość produkowanej żywicy znajduje zastosowanie w przemyśle drzewnym i meblarskim jako klej do płyt wiórowych, pilśniowych (MDF i HDF) oraz sklejki drzewnej. Jej bardzo szerokie zastosowanie wynika z faktu, że jest tania, szeroko dostępna, ma stosunkową niską temperaturę klejenia na gorąco i nie jest łatwopalna.
W rolnictwie
Na koniec zostawiliśmy omówienie głównego zastosowania mocznika. Ponad 90% światowej produkcji przemysłowej tej substancji jest wykorzystywana jako nawóz azotowy. Mocznik zawiera najwięcej azotu ze wszystkich stałych nawozów syntetycznych – 47%. Dla porównania: w azotanie(V) amonu azot stanowi już tylko 35% masy.
Dzięki wysokiej zawartości azotu oraz swojemu słabo zasadowemu charakterowi mocznik jest jednym z najbardziej uniwersalnych nawozów sztucznych. Można go stosować w uprawie zbóż, warzyw, kwiatów, drzew, krzewów owocowych oraz trawników.
Mocznik w glebie rozkładany jest w sposób opisany wcześniej przez ureazę produkowaną przez bakterie glebowe.
Łukasz Aranowski
27 października 2024
