Kwas ortofosforowy(III) – formy tautomeryczne
Kwas ortofosforowy(III) (H3PO3) zwany inaczej kwasem fosfonowym lub fosforawym to w temperaturze pokojowej białe, bezwonne krystaliczne ciało stałe doskonale rozpuszczalne w wodzie. Jest przykładem substancji, przy której warto się chwilę zatrzymać, aby czegoś ciekawego nauczyć naszych podopiecznych.
Najpierw ćwiczymy z uczniami zapis równań reakcji hydrolizy. Otrzymuje się go bowiem działając wodą na jego bezwodnik – sześciotlenek czterofosforu (P4O6) lub na trójchlorek fosforu (PCl3):
P4O6 + H2O → 4H3PO3
PCl3 + 3H2O → H3PO3 + 3HCl
Później ćwiczymy reakcje redoks. Podczas ogrzewania kwas ortofosforowy(III) ulega dysproporcjonowaniu z utworzeniem fosforowodoru i kwasu ortofosforowego(V):
4H3PO3 → 3H3PO4 + PH3
Jednak najciekawsze zostawiamy na koniec. 😊
Prosimy uczniów aby ułożyli z „Atomków” strukturę tego kwasu. Prawdopodobnie, większość z nich, kierując się swoją znajomością innych kwasów tlenowych, ułoży jego formę fosforynową. I jest to odpowiedź prawidłowa – taka struktura faktycznie istnieje, ale nie jest dominująca. Dopiero wskazówka, że kwas ortofosforowy(III) jest kwasem dwuprotonowym naprowadzi uczniów na jego dominującą formę tautomeryczną – formę H–fosfonianową. Zwracamy uczniom uwagę na obecność wiązania koordynacyjnego między atomem fosforu i tlenu.
Obie formy pozostają w równowadze bardzo silnie przesuniętej na formę H–fosfonianową. W efekcie tego jest to kwas dwuprotonowy. Moc kwasu ortofosforowego(III) jest bardzo podobna do kwasu ortofosforowego(V) – pKa1 = 2,2, pKa2 = 6,7.
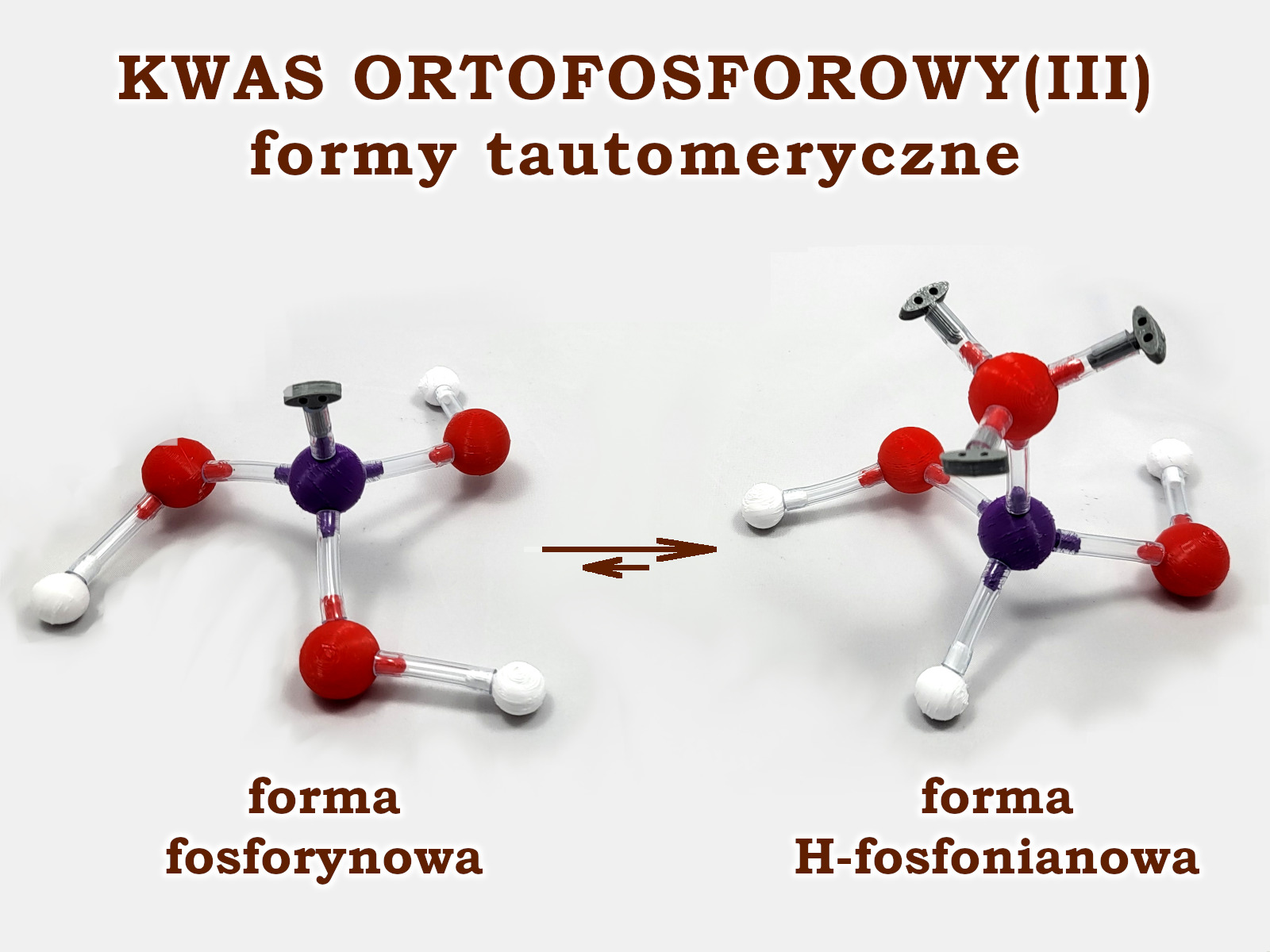
Omawiane struktury, z zaznaczeniem najważniejszych wolnych par elektronowych, widać na zdjęciu. Można je ułożyć korzystając z zestawu „Atomków” dedykowanego do nieorganicznych struktur Lewisa lub – zastępując wiązanie koordynacyjne wiązaniem podwójnym – korzystając z najprostszego zestawu 100-elementowego dla szkół podstawowych.
Struktury na zdjęciu – dla lepszej czytelności – zostały ułożone łącząc zestawy uproszczone i Lewisa.
Łukasz Aranowski
26 września 2023
