Kraking na poziomie szkoły podstawowej
Podstawa programowa obowiązująca od 1 września 2024 ustala, że uczeń szkoły podstawowej „...wyszukuje, porządkuje i prezentuje informacje o naturalnych źródłach węglowodorów oraz o produktach destylacji ropy naftowej i ich zastosowaniach; opisuje konsekwencje spalania paliw kopalnych dla środowiska, w tym klimatu...”.
Przewiduje zatem omówienie z uczniami procesu destylacji frakcyjnej (rektyfikacji) ropy naftowej i nazwanie oraz opisanie powstających frakcji. Nasz artykuł zachęca do pójścia dalej i omówienia z uczniami również procesu krakingu. Przy użyciu „Atomków” wyjdzie z tego ciekawa i angażująca lekcja znakomicie podsumowująca cały dział węglowodorów.
Kraking – trochę teorii
Kraking jest nazwą specyficzną dla procesu pirolizy ropy naftowej. Piroliza [gr. πυρ (pyr) – ogień, λύσις (lýsis) – rozłączenie], to rozkład związku chemicznego pod wpływem ciepła. Zatem kraking to po prostu termiczny rozkład wyższych alkanów zawartych w ropie naftowej na węglowodory o krótszych łańcuchach.
Potrzeba przetwarzania ropy naftowej w kierunku skrócenia łańcuchów zawartych w niej węglowodorów bierze się z głównego jej wykorzystania – jako źródła benzyny. Ale uzyskane węglowodory o małych cząsteczkach po rozdzieleniu i oczyszczeniu wykorzystuje się także jako surowce do syntezy innych ważnych związków alifatycznych.
W procesie otrzymywania chemikaliów wykorzystuje się kraking termiczny (przede wszystkim do produkcji etylenu), kraking parowy, w którym węglowodory rozcieńcza się parą wodną (również do produkcji etylenu, ale także propenu, butadienu i innych), a także hydrokraking, prowadzony w obecności wodoru w niższej temperaturze, ale za to przy wysokim ciśnieniu (do produkcji niższych alkanów).
Najczęściej jednak kraking wykorzystywany jest do produkcji benzyny. Podstawowym procesem jest tu kraking katalityczny, w którym wysokowrzące frakcje ropy naftowej (oleje) poddaje się rozkładowi w temperaturze około 500°C w obecności drobno sproszkowanego katalizatora glinowo‑krzemowego. To właśnie ten proces omówimy i zasymulujemy dalej.
Na koniec części teoretycznej warto wiedzieć – choć wiedza ta już wykracza poza percepcję ucznia szkoły podstawowej – że proces krakingu katalitycznego, który przedstawimy uczniom w formie uproszczonej, ma wiele różnych mechanizmów pobocznych i przebiega w pewnej części z udziałem karbokationów, które tworzą alkany i alkeny o silnie rozgałęzionych łańcuchach. Są to węglowodory bardzo pożądane w benzynie, gdyż zwiększają jej liczbę oktanową. Jednak sam proces krakingu nie wystarczy. Powiększa on liczbę oktanową surowej benzyny (od 40 do 60 – w zależności od źródła ropy i warunków rafinacji) do poziomu około 85. Ponieważ poziom użytkowy dla współczesnych silników zaczyna się od 95, więc i tak niezbędne jest dodawanie do niej środków przeciwstukowych, choć w mniejszej ilości.
Kraking katalityczny – symulacja procesu
Przeprowadzimy wraz z uczniami symulację procesu krakingu katalitycznego. Do symulacji potrzebny nam będzie zestaw rozszerzony (200‑elementowy) do chemii organicznej dla każdego zespołu uczniowskiego.
Prosimy uczniów, aby zbudowali cząsteczkę dodekanu. To najdłuższy alkan jaki mogą złożyć za pomocą tego zestawu. Gdy cząsteczka jest gotowa, mogą rozpocząć symulację procesu krakingu katalitycznego.
Uczniowie rozrywają cząsteczkę dodekanu w jednym, w dwóch lub w większej liczbie miejsc (według swojego uznania; maksymalnie w sześciu miejscach). Muszą pamiętać, że węgiel w węglowodorach jest zawsze czterowartościowy i żadne „nóżki” przy atomach węgla nie mogą pozostać puste. Uczniowie mogą korzystać z zestawu i podmieniać atomy węgla na takie z podwójnym wiązaniem, ale nie wolno im dobierać ani odkładać atomów wodoru. Liczba użytych atomów węgla i wodoru musi pozostać stała!
Szybko okaże się, że nie da się przeprowadzić podziału cząsteczki dodekanu tak, aby wszystkie produkty były nasycone. Nienasyconych produktów powstaje tyle, w ilu miejscach uczniowie przerwali łańcuch. Jeżeli więc łańcuch został przerwany w dwóch miejscach (jak w przykładzie na ilustracji), to powstaną dwa produkty nienasycone. Ostatecznie powstaje tylko jeden alkan i pewna liczba alkenów.
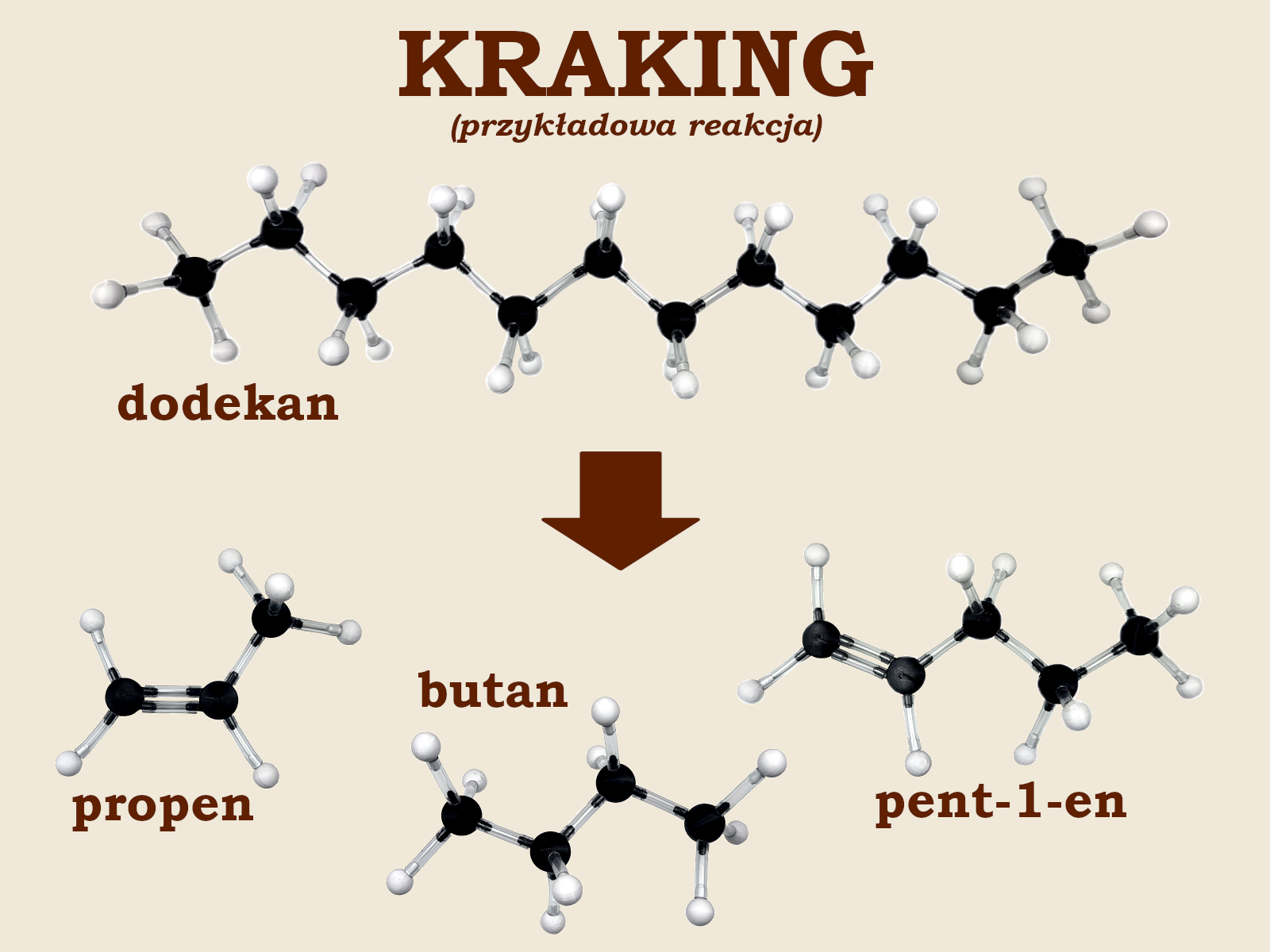
Uczniowie zapisują w zeszycie równanie przeprowadzonej przez siebie reakcji krakingu. Przykładowa reakcja pokazana na ilustracji wygląda następująco:
C12H26 → C5H10 + C4H10 + C3H6
Na koniec wspólnie nazywamy węglowodory otrzymane przez wszystkie zespoły uczestniczące w zabawie. Zastanawiamy się, jaki mają stan skupienia w temperaturze pokojowej (przypominamy uczniom, że zarówno alkany jak i alkeny zawierające poniżej pięciu atomów węgla są gazami). Stawiamy uczniom pytania powtórzeniowe. Na przykład: co się stanie, gdy gazowe produkty krakingu przepuścimy przez roztwór wody bromowej?
Przypominamy, że dzięki krakingowi otrzymaliśmy węglowodory świetnie nadające się do spalania w silnikach benzynowych. Piszemy więc reakcje ich spalania w tlenie.
Podsumowanie
Szczegółowe omówienie z uczniami procesu krakingu było tylko pretekstem do gruntownego powtórzenia wiadomości z działu „węglowodory”. Dzięki zabawie „Atomkami” i późniejszym omówieniu wyników tej zabawy przeszliśmy w zasadzie przez wszystkie punkty obowiązującej podstawy programowej (poza punktem 7 – czyli polimeryzacją; przeczytaj nasz artykuł o polimerach, które warto omówić z uczniami szkoły podstawowej).
Aby przeprowadzić opisaną wyżej lekcję niezbędne będą zestawy rozszerzone (200‑elementowe) do chemii organicznej. Najlepiej, gdy na każdej ławce znajdzie się jeden zestaw, ale uczniowie mogą pracować też w zespołach czteroosobowych (pierwsze ławki odwracają się do drugich, trzecie do czwartych itd.). W tym drugim przypadku na całą klasę wystarczy zaledwie osiem zestawów.
Łukasz Aranowski
12 listopada 2024
