Wiązania kowalencyjne
na przykładzie cząsteczek chlorowodoru, wody, amoniaku i metanu
część 3 z 3
Trzecia i ostatnia część cyklu o wiązaniach kowalencyjnych dla siódmoklasistów. Jeżeli nie przeczytałeś części pierwszej o dwuatomowych cząsteczkach pierwiastków lub części drugiej o tlenkach niemetali, to koniecznie zrób to przed lekturą tego wpisu.
Dzisiaj skupimy się na związkach wybranych niemetali z wodorem. Podstawa programowa wymienia cztery takie związki, których wzory sumaryczne i strukturalne uczeń szkoły podstawowej musi umieć. Są to: chlorowodór, woda, amoniak i metan. Omówimy budowę tych cząsteczek w sposób zrozumiały dla ucznia, który opanował już powłokową konfigurację elektronową pierwiastków.
Na uwagę zasługuje fakt, że po raz drugi w naszym cyklu pojawia się cząsteczka wody. Jest tak dlatego, iż wodę możemy traktować zarówno jako tlenek wodoru, więc omówiona została w tlenkach, jak i wodorek tlenu, więc wspomnimy o niej również omawiając najważniejsze związki wodoru.
Zapraszamy zatem do części trzeciej i ostatniej o związkach niemetali z wodorem.
🧪 HCl, cząsteczka chlorowodoru
Atomy chloru i wodoru, mimo widocznych na pierwszy rzut oka różnic, są w bardzo podobnej sytuacji. W obu przypadkach brakuje im jednego elektronu do konfiguracji gazu szlachetnego. Konfiguracja wodoru to K1, a chloru to: K2 L8 M7. Wodór potrzebuje jednego elektronu do dubletu, a chlor do oktetu elektronowego. Nic więc dziwnego, że oba atomy chętnie uwspólnią po jednym elektronie osiągając pożądane konfiguracje. Dzięki temu atom chloru łączy się pojedynczym wiązaniem kowalencyjnym z atomem wodoru tworząc cząsteczkę chlorowodoru H—Cl.
Ponieważ cząsteczka ta składa się z atomów różnych pierwiastków, więc ponownie musimy wspomnieć o polaryzacji wiązania. Różnica elektroujemności pomiędzy chlorem i wodorem wynosi 0,96 i z tego powodu wiązanie pomiędzy tymi atomami jest spolaryzowane. Para elektronów tworząca wiązanie jest przesunięta w kierunku atomu chloru, który ma większą elektroujemność. Powstały dipol posiada cząstkowy ładunek dodatni na atomie wodoru i odpowiadający mu wartością ładunek ujemny na atomie chloru.
W temperaturze pokojowej chlorowodór jest bezbarwnym gazem o kwaśnym duszącym zapachu. Znakomicie rozpuszcza się w wodzie, tworząc kwas solny (HClaq). Z tego powodu nie tylko wdychanie chlorowodoru jest bardzo szkodliwe dla zdrowia, ale nawet samo przebywanie w jego otoczeniu wywołuje ból oczu, łzawienie i zaczerwienienie spojówek.

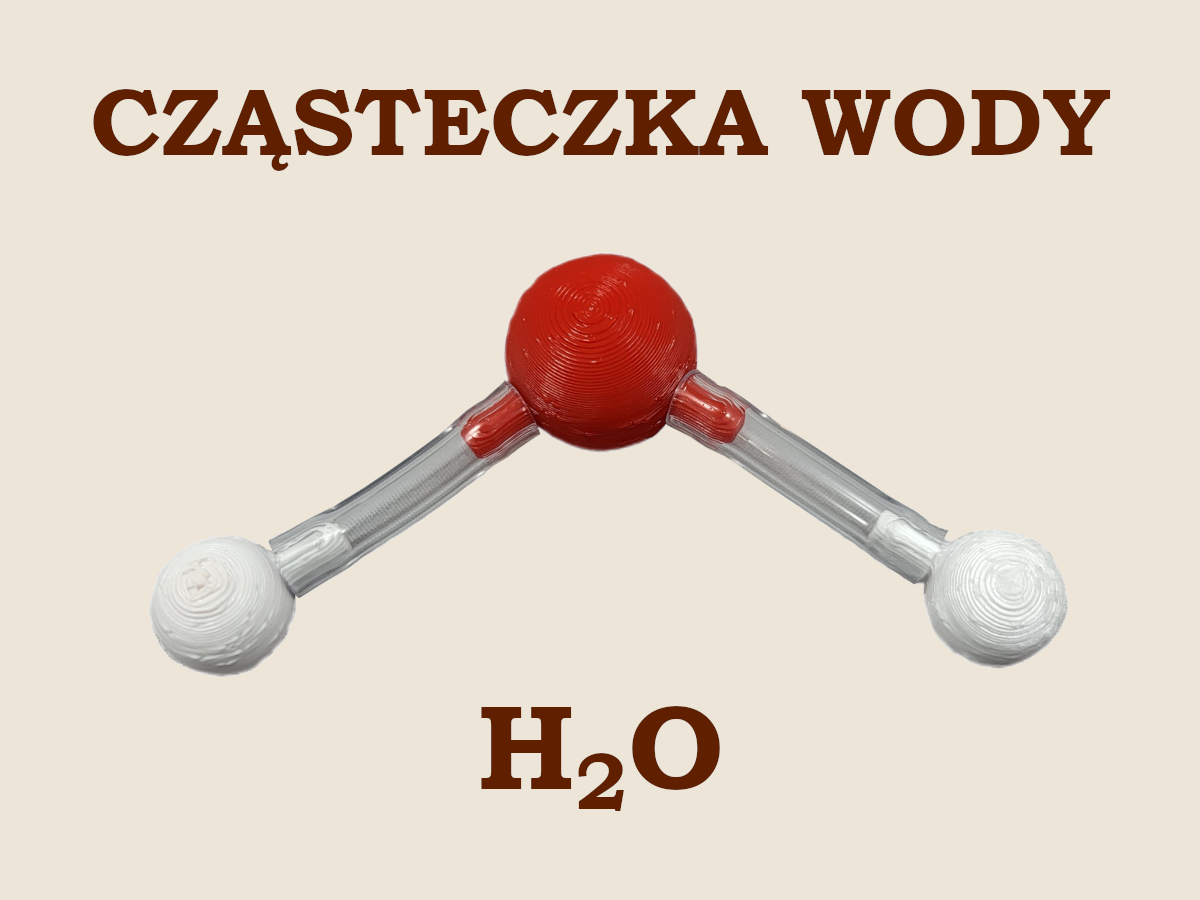
🧪 H2O, cząsteczka wody
Budowę cząsteczki wody oraz sposób w jaki powstają jej wiązania omówiliśmy dokładnie w części drugiej cyklu poświęconej tlenkom niemetali. Nie będziemy więc jej powtarzać. Ponieważ jednak jest to bardzo ważny związek wodoru, to należy tutaj o nim wspomnieć i jeszcze raz pokazać jego strukturę.
🧪 NH3, cząsteczka amoniaku
Konfiguracja elektronowa atomu azotu to K2 L5. Do oktetu elektronowego brakuje mu trzech elektronów. Chętnie więc uwspólni swoje trzy elektrony w zamian za trzy elektrony od innych atomów. Każdy z atomów wodoru może uwspólnić tylko jeden elektron, więc aby wszystkie atomy w cząsteczce uzyskały pożądaną konfigurację, do atomu azotu przyłączają się trzy atomy wodoru.
Tak powstaje cząsteczka amoniaku (azanu) zawierająca trzy kowalencyjne pojedyncze wiązania spolaryzowane (różnica elektroujemności: 0,84). Elektrony w tych wiązaniach przesunięte są w kierunku atomu azotu jako pierwiastka o większej elektroujemności.
Amoniak w temperaturze pokojowej jest bezbarwnym, trującym gazem o duszącym zapachu. Bardzo dobrze rozpuszcza się w wodzie, tworząc tzw. wodę amoniakalną (NH3∙H2O) Jego wdychanie w dużym stężeniu może spowodować nawet śmierć z powodu obrzęku gardła.

🧪 CH4, cząsteczka metanu
Atom węgla ma o jeden elektron mniej niż atom azotu, więc jego konfiguracja elektronowa, to K2 L4. Do konfiguracji gazu szlachetnego brakuje mu aż czterech elektronów. Uwspólni więc swoje cztery elektrony w zamian za cztery elektrony od atomów wodoru. Jak pamiętamy, jeden atom wodoru może uwspólnić tylko jeden elektron, więc w celu uzyskania oktetu przez atom węgla muszą przyłączyć się do niego cztery atomy wodoru.
Tak powstaje cząsteczka najprostszego węglowodoru – metanu. Zawiera ona cztery kowalencyjne pojedyncze wiązania o różnicy elektroujemności: 0,35. Wiązania o tak małej różnicy elektroujemności (poniżej 0,4) uznajemy za niespolaryzowane, a związki chemiczne z takimi wiązaniami za niepolarne.
Metan jest bezbarwnym i bezwonnym gazem, głównym składnikiem gazu ziemnego. Egzoenergetycznie reaguje z tlenem z powietrza i dlatego jest palny, a wymieszany z powietrzem w odpowiednich proporcjach tworzy mieszaninę wybuchową.

Informacje dodatkowe
Aby zbudować cząsteczki chlorowodoru, wody i amoniaku siódmoklasista powinien posiadać zestaw podstawowy (stuelementowy) do chemii nieorganicznej. Jednak budowa cząsteczki metanu (jako związku organicznego) będzie możliwa dopiero z zestawem podstawowym (stuelementowym) do chemii organicznej. Zestaw ten umożliwia zbudowanie także pozostałych cząsteczek omówionych w tej części (chlorowodoru, wody i amoniaku). Paradoksalnie więc – choć w większości rozmawiamy o związkach nieorganicznych – to zestaw do chemii organicznej umożliwi zbudowanie wszystkich omówionych dzisiaj struktur.
Oczywiście, wszystkie struktury opisane w całym cyklu można ułożyć także korzystając z zestawów rozszerzonych (dwustuelementowych).
🧐 Zobacz też 🧐
Wszystkie artykuły cyklu o wiązaniach kowalencyjnych:
- Wiązania kowalencyjne – na przykładzie cząsteczek wodoru, chloru, tlenu i azotu (część 1 z 3),
- Wiązania kowalencyjne – na przykładzie cząsteczek wody i dwutlenku węgla (część 2 z 3),
- Wiązania kowalencyjne – na przykładzie cząsteczek chlorowodoru, wody, amoniaku i metanu (część 3 z 3) ← tu jesteś.
Łukasz Aranowski
12 marca 2024
